4.1. Порядок обработки стоматологических инструментов
Изделия медицинского назначения в зависимости от риска передачи возбудителя инфекции разделяют на три категории: критические (высокого риска заражения), полукритические (среднего риска заражения) и некритические (малого риска заражения).
К критическим медицинским (стоматологическим) инструментам относят инструментарий и материалы, которые в процессе их использования соприкасаются с раневой поверхностью, контактируют с кровью или инъекционными препаратами, а также отдельные виды стоматологических инструментов, которые в процессе эксплуатации взаимодействуют со слизистой оболочкой и могут вызвать её повреждение. Критический медицинский стоматологический инструментарий должен быть одноразовым или подвергаться стерилизации. При невозможности автоклавирования критические инструменты могут быть обработаны методом газовой стерилизации с использованием оксида этилена, а также методами низкотемпературной стерилизации.
Полукритическими медицинскими (стоматологическими) инструментами и материалами являются те, которые контактируя со слизистой оболочкой не вызывают её повреждения (например, зубоврачебное зеркало и др.). Большинство полукритических предметов подвергают дезинфекции высокого уровня с использованием химических дезинфектантов (глутаровый альдегид, хлорактивные вещества с концентрация активного хлора не менее 1000 мг/л, стабилизированная перекись водорода, надуксусная кислота).
Изделия малого риска передачи возбудителя (некритические) в процессе использования контактируют только с интактной кожей. Например, предметы окружающей среды, находящиеся в непосредственном соприкосновении с пациентом (стоматологическое кресло, медицинская мебель, термометр и др.). Для обработки этих изделий проводят дезинфекцию низкого уровня (например, с использованием 3% раствора хлорамина, ПАВ).
Инструменты однократного применения после использования подвергают дезинфекции. Одноразовые изделия, не промывая дополнительно и не разбирая, погружают, заполняя внутренние полости и каналы, в один из дезинфицирующих растворов:
6,0% перекись водорода – 60 мин;
5,0% раствор хлорамина – 60 мин;
0,5% активированный раствор хлорамина – 60 мин;
1,5% раствор нейтрального гипохлорита кальция – 60 мин.
После дезинфекции медицинские изделия однократного применения собирают в непрокалываемые контейнеры с соответствующей маркировкой и хранят до их утилизации (вывоза специализированной организацией, имеющей лицензию на обращение с медицинскими отходами). При отсутствии таких организаций обеззараживание использованных шприцев инъекционных осуществляют в паровом стерилизаторе (автоклаве) при температуре 132С 20 мин с целью подвергнуть их деструкции (изменению внешнего вида и потере потребительских свойств).
Инструменты многоразового применения подвергают дезинфекции с использованием физических или химических методов дезинфекции, выбор которых определяет конструкция, материал и назначение стоматологического инструментария. Стоматологические инструменты, подлежащие стерилизации, подвергают предстерилизационной очистке и стерилизации.
Боры и эндоодонтические инструменты (каналонаполнители, прикорневые иглы, дрильборы, пульпоэкстракты).
В современных условиях эндодонтические инструменты должны быть одноразового применения, после использования они подвергаются дезинфекции и в дальнейшем — утилизации. Новые эндоскопические инструменты используют только после проведения предстерилизационной очистки и стерилизации. При необходимости повторного использования отработанные эндодонтические инструменты, а также боры во время приёма помещают в раствор, состоящий из равных долей 3% перекиси водорода и 10% нашатырного спирта. Дезинфекцию предварительно очищенных от органических загрязнений боров и другого мелкого инструментария можно проводить 70% этиловым спиртом, средством «Сайдекс». Обеззараживание инструментов средством «Сайдекс» проводят в течение 15 мин, 70% этиловым спиртом -30 мин.
Однако, указанные инструменты предпочтительно обрабатывать с применением дезинфекционных средств, позволяющих объединить дезинфекцию и предстерилизационную очистку в один процесс (см Приложение 1). Инструменты погружают в раствор дезинфектанта сразу после их использования, не допуская подсушивания. Время дезинфекции 30 мин. При проведении дезинфекции и предстерилизационной обработки с применением ультразвука ее время сокращают до 15 мин.
Остальные стоматологические инструменты, в том числе инструменты, для замешивания фиксирующего цемента, резиновые чашки, многоразовые наконечники для слюноотсосов и т.д. обеззараживают в 3% растворе хлорамина 60 мин, 4% растворе средства «Лизетол АФ» — 30 мин, 4% растворе средства ИД-212 — 30 мин, 2% растворе средства «Дюльбак ДТБ/л» — 45 мин.
Карпульные шприцы после каждого пациента обеззараживают двукратным протиранием стерильным тампоном, смоченным 70% спиртом, в конце смены стерилизуют. Наконечники к бормашинам дезинфицируют путем двукратного протирания (до и после лечения пациента) наружных поверхностей и канала для бора стерильным марлевым тампоном, смоченным 70% этиловым спиртом, 3% раствором хлорамина.
Два раза в день после первой смены и в конце рабочего дня дезинфицируют отсасывающие установки. Для этих целей используют 2% раствор средства «Шульке и Майер Матик» или 1% раствор средства Оротол Ультра. Рабочий раствор указанных средств объемом 1л пропускают через отсасывающую систему зубоврачебной установки в течение 2 мин и затем оставляют в ней на 30 мин.
После препарирования зубов с раскрытием зубодесневого желобка (т.е. при наличии крови) перед дезинфекцией необходимо пропустить через систему стакан холодной воды.
Каменные диски используют однократно и затем после дезинфекции утилизируют. Слепочные ложки механически очищают от остатков слепочной массы и погружают в дезинфицирующий раствор. Стерилизацию ложек проводят паровым или воздушным методом. Хранят в упаковке, в которой проводилась стерилизация. Повторное применение пластиковых ложек, не подлежащих стерилизации, не допускается.
Стаканы многоразового использования обеззараживают погружением на 60 мин в 3% раствор хлорамина.
По окончании экспозиции стаканы промывают проточной водой, до полного исчезновения запаха дезинфектанта и хранят в специальной емкости.
В ортопедическом кабинете дезинфекции подлежат и зубопротезные изделия. Дезинфекцию изделий проводят перед направлением в зуботехническую лабораторию и перед внесением в полость рта. Оттиски, зубопротезные заготовки предварительно отмывают водой, соблюдая при этом противоэпидемические меры индивидуальной защиты.
Режимы дезинфекции стоматологических оттисков из альгинатных, силиконовых материалов, полиэфирной смолы гидроколлоида, зубопротезных заготовок из металла, керамики, пластмасс и др. материалов представлены в Приложении 2.
Емкость с дезинфекционным раствором закрывают крышкой. По окончании дезинфекции оттиски, зубопротезные заготовки промывают проточной водой по 30 сек. Средство «МД-520» используют многократно в течение недели, обрабатывая при этом не более 50 оттисков. При изменении внешнего вида раствора его следует заменить.
Обеззараженные зубопротезные изделия помещают в индивидуальную упаковку для хранения. Перед внесением в полость рта протез ополаскивают водопроводной водой.
После дезинфекции стоматологические инструменты многократного применения, за исключением зеркал, подвергают предстерилизационной очистке и стерилизации.
Предстерилизационная очистка имеет целью удаление белковых, жировых, механических загрязнений, а также лекарственных препаратов.
Наиболее целесообразно и рационально предстерилизационную очистку и стерилизацию стоматологического инструментария и изделий проводить в централизованных стерилизационных отделениях (ЦСО), которые оборудуются при данном лечебном учреждении для удовлетворения собственных потребностей или обслуживания нескольких лечебных учреждений.
Предстерилизационная очистка и стерилизация стоматологических инструментов производится в соответствии с требованиями «Инструкции по очистке (мойке) и стерилизации стоматологических инструментов» №1609-77 от 11 марта 1977 г., требованиями ОСТ 42-2-2-77 «Стерилизация и дезинфекция изделий медицинского назначения. Методы, средства и режимы», а также Методическим письмом ЦГСЭН в г. Москве от 21.03.95 № 12/20-208 «Организация санитарно-гигиенического и дезинфекционно-стерилизационного режимов в учреждениях стоматологического профиля».
Предстерилизационная очистка стоматологического инструментария осуществляют ручным способом или механизированным с помощью специального оборудования с применением моющих растворов.
Предстерилизационную обработку ручным способом проводят в следующей последовательности:
каждый инструмент предварительно ополаскивают проточной водой в отдельной моечной ванне в течение 30 сек.;
полностью погружают инструменты на 15 минут в бачок с горячим (t°= +50°С) моющим раствором, состоящим из комплекса 0,5% раствора перекиси водорода с 0,5% раствором одного из моющих средств: «Астра», «Лотос», «Новость», «Айна». При применении моющего средства «Биолот» время обработки составляет 3 минуты;
моют инструменты в этом же растворе ершами или ватно-марлевыми тампонами в течение 30 сек.;
ополаскивают проточной водопроводной водой из расчета 2000 мл воды на каждое изделие и затем дистиллированной водой в течение 30 сек.; в случае использования моющих средств «Лотос» или «Астра» время ополаскивания должно быть равно одной минуте;
сушат в суховоздушном стерилизаторе горячим воздухом при температуре 80-85° С до полного исчезновения влаги.
Механизированная предстерилизационная очистка должна производиться с помощью аппаратов и оборудования струйным методом, ультразвуком или ершеванием также с применением моющих средств. Методика проведения механизированной очистки должна соответствовать инструкции по эксплуатации, прилагаемой к оборудованию.
Моющий раствор после обработки инструментария, загрязненного кровью, немедленно выливается и заменяется свежим.
Стоматологический инструментарий, использованный при гнойных операциях и при лечении инфекционных больных, перед предстерилизационной очисткой подлежит обязательному обеззараживанию в комплексе 3% перекиси водорода с моющими средствами «Астра», «Лотос», «Айна» или «Новость» при температуре 50 С в течение 30 минут или другими кислородсодержащими, поверхностноактивными соединениями, после чего выполняются вышеописанные этапы предстерилизационной обработки.
Контроль качества предстерилизационной обработки стоматологического инструментария и изделий проводят методами, рекомендуемыми «Методическими указаниями по предстерилизационной очистке изделий медицинского назначения».
Качество предстерилизационной очистки инструментов проверяют путем постановки амидопириновой или азопирамовой проб на наличие крови и определения остаточных количеств щелочных компонентов моющего препарата при помощи постановки пробы с фенолфталеином (Приложение 3).
Инструменты или изделия, давшие положительные пробы на кровь, обрабатывают повторно, а содержащие остаточные количества моющих средств — повторно промывают проточной водой.
Все изделия (инструменты, перевязочные материалы, посуда и др.), соприкасающиеся с раневой поверхностью, контактирующие с кровью или инъекционными препаратами, а также со слизистой оболочкой и могущие вызвать ее повреждение, должны подвергаться стерилизации.
Для стерилизации применяют физические и химические методы. Выбор метода определяется видом стерилизуемого материала, который после стерилизации должен сохранять свои основные свойства. Используют физический и химический методы стерилизации. Химический метод стерилизации является более щадящим и применяется для стерилизации изделий, имеющих зеркальную поверхность, изготовленных из полимерных материалов, режущих и колющих инструментов с микронной заточкой и др. В Приложении 4 представлены режимы стерилизации медицинских изделий растворами химических средств.
Контроль стерильности стоматологических инструментов проводят бактериологические лаборатории ТО Роспотребнадзора 2 раза в год или бактериологические лаборатории лечебных учреждений 1 раз в месяц.
Контролю на стерильность подлежит не менее 1% от общего количества простерилизованного инструментария, но не менее 3-5 единиц одного наименования.
Инструменты считаются стерильными при отсутствии роста вегетативных и спорообразующих форм микроорганизмов.
При работе с дезсредствами необходимо строгое соблюдение требований техники безопасности и производственной санитарии.
9. Предстерилизационная подготовка и методы стерилизации инструментов.
Предстерилизационная подготовка складывается из обеззараживания, мытья и высушивания. Ей подвергают все виды инструментов.
Вид и объём предстерилизационной обработки в недавнем прошлом зависел от степени инфицированности инструментов. Так, раньше существенно отличалась обработка инструментов после чистых операций (перевязок), гнойных операций, операций у больных, перенёсших гепатит и относимых к группе риска по СПИДу. Однако в настоящее время, учитывая высокую опасность распространения ВИЧ-инфекции, правила предстерилизационной подготовки ужес- точены и приравнены к способам обработки инструментов, предусматривающим безусловную гарантию уничтожения ВИЧ. Следует отметить, что инструменты после гнойных операций, операций у больных, перенёсших в течение последних 5 лет гепатит, а также при риске ВИЧ-инфекции обрабатывают отдельно от других.
Все процедуры предстерилизационной обработки обязательно выполняют в перчатках!
Обеззараживание
Непосредственно после использования инструменты погружают в ёмкость с дезинфицирующими средствами (накопитель). При этом они должны быть полностью погружены в раствор. В качестве дезинфицирующих средств используют 3% раствор хлорамина (экспозиция 40- 60 мин) или 6% раствор перекиси водорода (экспозиция 90 мин). После обеззараживания инструменты промывают проточной водой.
Мытьё
Инструменты погружают в специальный моющий (щелочной) раствор, в его состав входят моющее средство (стиральный порошок), пероксид водорода и вода. Температура раствора 50-60 ?С, экспозиция 20 мин. После замачивания инструменты моют щётками в том же растворе, а затем — в проточной воде.
Высушивание можно осуществлять естественным путём. В последнее время, особенно при последующей стерилизации горячим воздухом, инструменты сушат в сухожаровом шкафу при температуре 80 ?С в течение 30 мин. После высушивания инструменты готовы к стерилизации.
10. Особенности стерилизации инструментов с оптической системой.
Основной метод стерилизации оптических инструментов, требующих щадящей обработки с исключением нагревания, — газовая стерилизация. Этим способом обрабатывают все инструменты для проведения лапароскопических и торакоскопических вмешательств, что связано со сложным их устройством.
При стерилизации фиброгастроскопов, холедохоскопов, колоноскопов возможно применение и холодной стерилизации с использованием химических антисептиков (хлоргексидина).
Следует особо отметить, что наилучшим способом профилактики контактной инфекции признано использование одноразового инструментария, подвергшегося лучевой заводской стерилизации!
11. Восьмиобразная повязка на голеностопный сустав
Показание: фиксация голеностопного сустава при травмах.
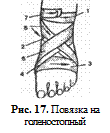 Оснащение: бинт
5х10 см, ножницы.
Оснащение: бинт
5х10 см, ножницы.
Последовательность действий(рис. 17):
1. Усадить пациента, успокоить, объяснить ход предстоящей манипуляции. Положить на рану стерильную салфетку.
2. Уложить ногу на специальную подставку (или стул), стопа должна свисать.
3. Взять начало бинта в левую руку, головку бинта — в правую, бинтовать слева направо.
4. Сделать два закрепляющих тура бинта вокруг нижней трети голени.
5. Вести бинт по тыльной поверхности голеностопного сустава, вокруг стопы, вернуться на тыльную поверхность стопы.
6. Сделать перекрест и далее на голень для закрепляющего тура (при бинтовании носок стопы должен быть натянут к голени).
Примечание.Если пациент не может сам натянуть носок стопы к себе, ему помогает медицинский работник при наложении бинтовой повязки.
7. Повторить, чередуя ходы бинта до полной фиксации сустава.
8. Закрепить повязку двумя закрепляющими турами вокруг голени.
Восьмиобразная повязка кисти.
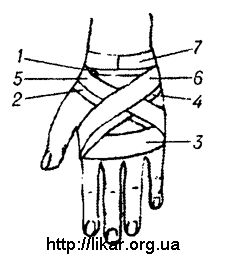
Повязка начинается круговым ходом на запястье (1). По тылу кисти бинт идет косо (2) и переходит на ладонь, закрепляется круговым ходом (3) и косо но тылу кисти возвращается на запястье (4), пересекая второй ход. В дальнейшем второй и четвертый ходы повторяются (5 и 6). Закрепляют повязку на запястье (7).
МЕТОДИЧЕСКАЯ РАЗРАБОТКА ПРАКТИЧЕСКОГО ЗАНЯТИЯ для Самоподготовки студентов на тему «Предстерилизационная очистка инструментов медицинского назначения»
Департамент здравоохранения Ивановской области
Областное государственное бюджетное
профессиональное образовательное учреждение
«Кинешемский медицинский колледж»
СОГЛАСОВАНО Рассмотрено на заседании ЦМК
Зам. директора по УР: Председатель ЦМК
«______»___________20__г «____»__________20__г
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
ПРАКТИЧЕСКОГО ЗАНЯТИЯ
для самоподготовки студентов
Предмет: ОП.16. Инфекционная безопасность
Тема: Предстерилизационная очистка инструментов
медицинского назначения.
Занятие: №-4
Специальность: 31.02.02 «Акушерское дело» базовый уровень
Составлена преподавателем:
Татаренко Л. В.
Кинешма 2018 г.
Тема: «Предстерилизационная очистка инструментов медицинского назначения.»
Место проведения: кабинет доклинической практики.
Количество часов: 90 минут
Цель самоподготовки:
1. Научиться выделять главное из прочитанного.
2. Научиться составлять план по каждому разделу темы.
3. Научиться отвечать конкретно, строго по плану.
4. Уметь грамотно пользоваться алгоритмами манипуляций и применять их на практике.
Учебные цели:
В результате освоения учебной дисциплины обучающийся должен:
знать:
З.1. понятия «инфекционный процесс», «внутрибольничная инфекция»
З.2. способы передачи инфекции в лечебно-профилактическом учреждении
З.3. виды возбудителей внутрибольничной инфекции
З.4. меры профилактики и контроля ВБИ.
З.5. организацию работы медсестры процедурного кабинета и его оснащение;
З.6. новые виды игл и других приспособлений, позволяющих свести до минимума контакт медсестры с кровью пациента;
З.7. способы дезинфекции, стерилизации многоразового инструментария;
З.8. технику безопасности медсестры при работе с дезинфицирующими средствами и биологическими жидкостями пациента;
З.9. особенности социальной, гигиенической и хирургической обработки рук;
З.10. преимущества и недостатки различных групп дезинфектантов;
З.11. действующие нормативные документы;
З.12. требования к личной гигиене и медицинской одежде персонала;
З.13. меры профилактики парентеральных гепатитов и ВИЧ-инфекций в лечебно-профилактических учреждениях;
З.14. санитарно-эпидемиологический режим лечебно-профилактических учреждений;
уметь:
У.1 Пользоваться различными дезинфицирующими средствами;
У.2 Оказать первую помощь при попадании дезинфицирующих средств на слизистые и глаза.
У.3 Использовать знания нормативной документации, регламентирующей способы, режимы и средства очистки, дезинфекции и стерилизации;
У.4 Проводить санитарно-просветительскую работу с населением по профилактике ВИЧ-инфекции;
У.5 Проводить санитарно-просветительную работу с населением по профилактике парентеральных гепатитов.
У.6 Составлять план противоэпидемических мероприятий при выявлении больного вирусным гепатитом.
У.7 Проводить мероприятия при попадании биологических жидкостей пациента на кожу и слизистую оболочки.
У.8 Выполнять правила техники безопасности при выполнении различных манипуляций.
У.9 Проводить социальную, гигиеническую и хирургическую обработку рук.
У.10 Соблюдать технику безопасности при работе с биологическими жидкостями;
У.11 Соблюдать требования санитарно-эпидемиологического режима;
У.12 Осуществлять дезинфекцию предметов ухода за пациентами, белья, инструментов;
У.13 Осуществить дезинфекцию и утилизацию использованного одноразового медицинского инструментария;
Освоение программы учебной дисциплины способствует формированию общих и профессиональных компетенций:
Ок 1. Понимать сущность и социальную значимость своей будущей профессии, проявлять к ней устойчивый интерес.
Ок 2. Организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их эффективность и качество.
Ок 3. Принимать решения в стандартных и нестандартных ситуациях и нести за них ответственность.
Ок 4. Осуществлять поиск и использование информации, необходимой для эффективного выполнения возложенных на него профессиональных задач, а также для своего профессионального и личностного развития.
Ок 5. Использовать информационно-коммуникационные технологии в профессиональной деятельности.
Ок 6. Работать в коллективе и команде, эффективно общаться с коллегами, руководством, потребителями.
Ок 7. Брать ответственность за работу членов команды (подчиненных), за результат выполнения заданий.
Ок 8. Самостоятельно определять задачи профессионального и личностного развития, заниматься самообразованием, осознанно планировать и осуществлять повышение своей квалификации.
Ок 9. Ориентироваться в условиях частой смены технологий в профессиональной деятельности.
Ок 10. Бережно относиться к историческому наследию и культурным традициям народа, уважать социальные, культурные и религиозные различия.
Ок 11. Быть готовым брать на себя нравственные обязательства по отношению к природе, обществу, человеку.
Ок 12. Организовывать рабочее место с соблюдением требований охраны труда, производственной санитарии, инфекционной и противопожарной безопасности.
ОК 13. Вести здоровый образ жизни, заниматься физической культурой и спортом для укрепления здоровья, достижения жизненных и профессиональных целей.
Пк 4.7. Обеспечивать инфекционную безопасность.
Пк 4.8. Обеспечивать безопасную больничную среду для пациентов и персонала.
Пк 4.9. Участвовать в санитарно-просветительской работе среди населения.
ПК 4.11. Обеспечивать производственную санитарию и личную гигиену на рабочем месте.
Студент должен на занятии
знать:
— Этапы предстерилизационной очистки шприцов и игл, резиновых изделий.
— Правила приготовления и применения моющих растворов.
— Меры предосторожности при приготовлении и применения растворов.
— Требования к личной гигиене и медицинской одежде персонала
уметь:
— приготовить моющий раствор для ПСО.
— соблюдать меры предосторожности при приготовлении и применения моющих растворов для ПСО.
— осуществлять предстерилизационную очистку изделий медицинского назначения
— осуществлять контроль качества предстерилизационной очистки.
выполнять зачетные манипуляции
— приготовление моющих растворов для ПСО.
— осуществлять предстерилизационную очистку изделий медицинского назначения
— осуществлять контроль качества предстерилизационной очистки.
Оснащение
— водный термометр; мерные емкости; емкости для приготовления растворов
— шприцы, иглы, инструменты; ерши, мандрены
— порошки “ Биолот”, “ Лотос”- дистиллированная вода
— растворы: 33 % раствор перекиси водорода; 3 % раствор хлорамина
Фенолфталеина; азопирама
— часы;- марлевые салфетки; — пипетка;- электронагреватель
Ход самоподготовки:
1. Контроль исходного уровня знаний (претесты)
2. Изучение теоретического материала
3. Вопросы для самоконтроля знаний по теоретическому материалу.
4. Изучение алгоритмов практических манипуляций.
5. Самостоятельная работа.
6. Закрепление и контроль изученного материала (посттесты)
7. Задание на дом
8. Список литературы.
1. Контроль исходного уровня знаний
Тестовые задания для самоконтроля знаний
Претесты.
1. Предстерилизационная очистка имеет этапов.
2. Для приготовления моющего раствора на 1 л берется моющего раствора:
а) 5 г
б) 50 г
в) 15 г
г) 10 г
3. Моющий раствор со средством “ Биолот” используется
4. На I этапе предстерилизационной очистке используют раствор хлорамина:
а) 3 %
б) 0,3 %
в) 5 %
г) 1%
5. Моющий раствор с использованием моющего средства “ Лотос” применяют:
а) в течение суток нагревается до 6 раз
б) в течение суток до появления фиолетовой окраски
в) в течение суток до появления розовой окраски
г) в течение суток нагревать можно до 6 раз, до появления розовой окраски.
6. Температура моющего раствора 45 0С необходима при использовании моющего средства:
а) “ Лотос”
б) “Астра”
в) “ Прогресс”
г) “ Биолот”
7. Шприцы и иглы находятся в моющем растворе при полном погружении:
а) 3 мин
б) 15 мин
в) 20 мин
г) 45 мин
8. Установите правильную последовательность этапов предстерилизационной очистки:
а) замачивание в 3 % растворе хлорамина
б) замачивание в моющем растворе
в) промывание проточной водой
9. В течение 15 мин проводится этап предстерилизационной очистки.
10. Для приготовления 1 литра 3 % раствора хлорамина нужно взять:
а) 300 г хлорамина + 1 литр воды
б) 30 г хлорамина + 1 литр воды
в) 30 г хлорамина + 970 мл воды
г) 30 г хлорамина + 3 л воды
2. Краткий теоретический материал
Предстерилизационная (биологическая) очистка проводится после дезинфекции и отмывания остатков дезинфицирующих средств проточной питьевой водой.
Цель предстерилизационной очистки – удаление белковых, жировых, механических загрязнений и остаточных количеств лекарственных препаратов.
Предстерилизационной очистке должны подвергаться все изделия медицинского назначения перед их стерилизацией. Предстерилизационная очистка, выполняется в строгой последовательности, определенной ОСТ 41-21-2-85, ей подвергаются все инструменты, стеклянные изделия мед- назначения, резиновые изделия, перчатки с целью удаления белковых, жировых и механических загрязнений, а также лекарственных препаратов.
Предстерилизационную очистку проводят ручным и механическим способами.
От качества предстерилизационной обработки и дезинфекции медицинских инструментов и материалов зависит состояние противоэпидемиологического режима ЛПУ.
Моющие средства, применяемые для предстерилизационной очистки.
1. “ Биолот”
Моющий раствор с “Биолотом” подогревается до t 40-45 0С к моменту погружения в него инструментов. Раствор моющего средства “ Биолот” используется однократно!
2. Комплекс, состоящий из перекиси водорода с моющим средством: “Астра”, “ Айна”, “ Лотос”, “ Прогресс”.
Раствор подогревается до t — 50-55 0С. Моющие растворы можно использовать в течение суток с момента приготовления (не более 6 раз), если цвет раствора не изменился (розовое окрашивание).
Этапы предстерилизационной очистки инструментов.
I этап — сразу после манипуляции следует погрузить инструменты и шприцы в разобранном виде, иглы погрузить в емкость с 3 % раствором хлорамина на 60 мин.
II этап — инструменты промывают под проточной водой до исчезновения запаха хлора.
III этап — инструменты полностью погружают в моющий раствор на 15 мин.
IV — этап — каждое изделие подвергается ершеванию, иглы прочищают мандреном.
V этап — каждое изделие промывают под проточной водой.
VI этап — ополаскивание дистиллированной водой.
VII — сушка горячим воздухом до исчезновения влаги.
ЗАПОМНИТЬ!
1. Вся предстерилизационная очистка проводится в перчатках.
2. Ватно-марлевые тампоны для механической очистки менять после каждой обработки.
3. Моющий раствор подогревать только к моменту погружения в него инструмента.
4. Соблюдать температурный режим моющего раствора (при более низкой температуре биологически активные вещества-ферменты-выделяются в раствор очень медленно, а при более высокой температуре-разрушаются).
5. Моющий раствор в течении суток можно подогревать до 6 раз или применять его до появления розового окрашивания (что свидетельствует о загрязнении кровью).
После проведения предстерилизационной очистки проводится контроль качества предстерилизационной очистки путем постановки проб:
1. На наличие крови:
— амидопириновая
— азопирамовая
2. На наличие остаточных количеств моющих средств:
— фенолфталеиновая
— азопирамовая
3. На наличие остатков хлорсодержащих препаратов:
— йодо — крахмальная.
Ежедневному контролю подлежит 1 % изделий, подвергающихся предстерилизационной очистке за смену, но не менее 3-5 штук каждого вида инструмента.
Контроль качества предстерилизационной очистки проводит Центр Госсанэпиднадзора и дезинфекционные станции-ежеквартально.
Самоконтроль в ЛПУ проводят:
— в центральных стерилизационных отделениях (ЦСО)-ежедневно.
— в отделениях-не реже одного раза в неделю (организует и контролирует его старшая медсестра или акушерка).
В случае положительной пробы на кровь или остаточное количество щелочных компонентов моющих средств всю партию контролируемых изделий, из которых отбирали на контроль, подвергают повторной очистке до получения отрицательных результатов. Результаты контроля фиксируются в журналах.
ЖУРНАЛ УЧЕТА КАЧЕСТВА ПРЕДСТЕРИЛИЗАЦИОННОЙ ОБРАБОТКИ
Начат «___» __________________2018г. Окончен «____» _______________20 г.
ДатаСпособ
обработки
Применяемое
средство
Результаты выборочного химического
Контроля обрабатываемых изделий
Ф.И.О.
Проводившего
контроль
Наименование
изделий
Количество
штук
Из них за
грязненных
Кровью
Моющими
средствами
ЖУРНАЛ УЧЕТА КАЧЕСТВА ПРЕДСТЕРИЛИЗАЦИОННОЙ ОЧИСТКИ
Начат «___» __________________2018г. Окончен «____» _______________20 г.
ДатаНаименование
предметов
Результаты
Ф.И.О.
того, кто
ставил пробу
Положительно
Отрицательно
Пробы, применяемые для контроля предстерилизационной очистки
1.Азопирамовая проба.
Оценка результатов пробы: результат учитывается до истечения 1 мин. Проба считается положительной, если цвет реактива меняется.
Если появилась бурое окрашивание до 1 мин, это означает наличие ржавчины или остатков хлорсодержащих средств (чтобы дифференцировать нужно дополнительно поставить йодокрахмальную пробу)
Если в срок до 1 мин появилось сине-фиолетовое окрашивание, это означает наличие на инструментарии остатков крови.
Розовое окрашивание свидетельствует о наличии остатков моющего средства (дополнительно поставить фенолфталеиновую пробу)
Если окрашивание наступило в срок более 1 мин, результат не учитывается. Готовый раствор азопирама может храниться в закрытом флаконе в темном холодном месте 2 месяца, при комнатной температуре не более месяца.
2. Амидопириновая проба:
Оценка результатов пробы: результат учитывается до истечения 1 мин. Проба считается положительной, если при наличии остатков крови возникает сине- зеленое окрашивание. (цвет реактива меняется.)
3.Фенолфталеиновая проба:
При наличии не отмытых компонентов моющих средств появляется розовое окрашивание в течении 1 минуты.
4. Йодо- крахмальная проба:
При наличии остатков хлорсодержащих препаратов проба меняет свой цвет с бесцветного на бурый или синий в течение 24 часов с момента дезинфекции.
При положительных результатах всех этих проб партия изделий подлежит повторной предстерилизационной очистке.
3. Вопросы для самоконтроля знаний по изученному материалу
1. Цель предстерилизационной очистки.
2. Моющие средства, применяемые для предстерилизационной очистки.
3. Контроль качества предстерилизационной очистки.
4. Оценка результатов проб.
4. Изучение алгоритмов практических манипуляций
Приготовление моющего раствора
для предстерилизационной обработки шприцев
1 способ
Цель: соблюдение инфекционной безопасности
Показания: Предстерилизационная очистка инструментов
Противопоказания: нет
Оснащение:
— порошок “ Биолот”;- дистиллированная вода
— электронагреватель; — водный термометр; — мерные емкости
— полотенце; — перчатки
Последовательность действий:
1. Вымыть руки, надеть перчатки.
2. Взять сосуд ёмкостью 2 литра
3. Отмерить в сосуд 995 мл дистиллированной воды
4. Отмерить и добавить 5 грамм порошка “ Биолот ”
5. Подогреть до 450 С.
Примечание: моющий раствор применять однократно!
Приготовление моющего раствора
для предстерилизационной обработки шприцев
2 способ
Цель: соблюдение инфекционной безопасности
Показания: Предстерилизационная очистка инструментов
Противопоказания: нет
Оснащение:
— порошок типа “Лотос”,”Айна”;- дистиллированная вода;- пергидроль
— мерные емкости;- водный термометр;- электронагреватель
— полотенце;- перчатки
Последовательность действий:
1. Вымыть руки, надеть перчатки.
2. Взять сосуд ёмкостью 2 литра
3. Отмерить в сосуд 975 мл дистиллированной воды
4. Отмерить и добавить 5 грамм порошка «Лотос», «Айна»
5. Отмерить и добавить в этот же сосуд пергидроль 20мл
6. Тщательно размешать раствор.
7. Подогреть до температуры 550 С.
Примечание: моющий раствор применять в течение суток до загрязнения
(до появления розовой окраски), но не более 6 раз.
Предстерилизационная очистка медицинского инструментария
многократного использования.
Цель: соблюдение инфекционной безопасности
Показания: подготовка к стерилизации
Противопоказания: нет
Оснащение:
— использованный инструментарий
— емкость с 3% раствором хлорамина
— емкость с моющим раствором
— ерши
— мандрены
— емкость с дистиллированной водой
Последовательность действий:
1. Погрузить мед. инструментарий в 3% раствор хлорамина на 1 час.
2. Промыть под проточной водой (до исчезновения запаха хлора).
3. Замочить в моющем растворе (полное погружение) на 15 минут.
4. Вымыть каждое изделие при помощи ерша в течение 30секунд, а иглы прочистить мандреном.
5. Промыть под проточной водой в течение 30 секунд каждый предмет, пропуская воду через полости инструментария.
6. Промыть инструментарий в дистиллированной воде в течение 30 секунд.
7. Осушить горячим воздухом до исчезновения влаги.
АЗОПИРАМОВАЯ ПРОБА.
Цель: соблюдение инфекционной безопасности.
Показания: контроль качества предстерилизационной обработки.
Противопоказания: нет.
Оснащение:
— раствор азопирама.
— 3% раствор перекиси водорода
— пипетки
— лоток
— инструментарий, подвергающийся контролю
— марлевые салфетки.
Последовательность действий:
1. Смешать раствор азопирама с раствором перекиси водорода в равных количествах для получения 1% раствора азопирама.
2. Нанести небольшое количество раствора на инструмент.
3. Держать инструмент над салфеткой, наблюдая за цветом стекающего реактива.
4. При проверке игл реактив набирают в чистый шприц и последовательно меняют иглы, пропускают реактив через них, выдавливая 3-4 капли на салфетку.
5. Оценить результат. Проба считается положительной, если цвет реактива изменяется в течение одной минуты:
— на сине-фиолетовый при наличии крови
— на розовый при наличии моющего средства
— на бурый при наличии ржавчины или хлорсодержащих средств
Примечания:
1. Исследуемые изделия должны иметь комнатную температуру.
2. Раствор (азопирам + перекись водорода) должен быть использован в течение 1-2 часов.
3. После проверки независимо от результата, изделия промывают чистой водой и повторяют П.О.
АМИДОПИРИНОВАЯ ПРОБА.
Цель: соблюдение инфекционной безопасности.
Показания: контроль качества предстерилизационной обработки (для выявления скрытой крови)
Противопоказания: нет.
Оснащение:
— пипетки
— лоток
— инструментарий, подвергающийся контролю
— марлевые салфетки.
— реактив амидопирина.
Последовательность действий:
1. Набрать реактив в пипетку.
2. Нанести небольшое количество раствора на инструмент.
3. Держать инструмент над салфеткой, наблюдая за цветом стекающего реактива.
4. При проверке игл реактив набирают в чистый шприц и последовательно меняют иглы, пропускают реактив через них, выдавливая 3-4 капли на салфетку.
5. Оценить результат. Проба считается положительной, если цвет реактива изменяется в течение одной минуты на сине-фиолетовый.
Примечания:
1. Исследуемые изделия должны иметь комнатную температуру.
2. После проверки независимо от результата, изделия промывают чистой водой и повторяют П.О.
ФЕНОЛФТАЛЕИНОВАЯ ПРОБА.
Цель: соблюдение инфекционной безопасности.
Показания: контроль качества предстерилизационной обработки (для выявления остатков СМС)
Противопоказания: нет.
Оснащение:
— пипетки
— лоток
— инструментарий, подвергающийся контролю
— марлевые салфетки.
— 1% спиртовой раствор фенолфталеина.
Последовательность действий:
1. Набрать реактив в пипетку.
2. Нанести небольшое количество раствора на инструмент.
3. Держать инструмент над салфеткой, наблюдая за цветом стекающего реактива.
4. При проверке игл реактив набирают в чистый шприц и последовательно меняют иглы, пропускают реактив через них, выдавливая 3-4 капли на салфетку.
5. Оценить результат. Проба считается положительной, если цвет реактива изменяется в течение одной минуты на розовый или фиолетовый.
Примечания:
1. Исследуемые изделия должны иметь комнатную температуру.
2. После проверки независимо от результата, изделия промывают чистой водой и повторяют П.О.
3. При использовании СМС “Прогресс”, “Биолот”, фенолфталеиновая проба не применяется.
обработку 5-6-7 этап.
6. Закрепление и контроль полученных знаний
Посттесты
1. Температура моющего раствора с использованием средств “ Биолот” должна быть:
а)45 0С
б) 55 0С
в) 65 0С
г) 75 0С
2. Количество этапов предстерилизационной очистки.
а)5
б)6
в)7
г) 8
3. Моющий раствор можно использовать до появления:
а) фиолетовой окраски
б) розовой окраски
в) зеленоватой окраски
г) синеватой окраски
4. Фенолфталеиновая проба служит для определения:
а) биологических загрязнений
б) следов крови
в) остатков моющего раствора
г) наличия микрофлоры
5. Температура моющего раствора с моющим средством “ Лотос” должно быть:
а) 60 0С
б) 45 0С
в) 55 0С
г) 65 0С
6. Амидопириновая проба служит для определения:
а) биологических загрязнений
б) следов крови
в) остатков моющего средства
г) наличия микрофлоры
7. В течение 60 мин проводится этап предстерилизационной очистки.
8. Для VI этапа предстерилизационная очистка используется вода:
а) проточная
б) прокипяченная
в) дистиллированная
г) дважды дистиллированная
9. При положительной амидопириновой пробе появляются:
а) сине- зеленого окрашивание
б) фиолетовое окрашивание
в) розовое окрашивание
г) черное окрашивание
10. Документ, регламентирующий предстерилизационная очистка .
Ситуационные задачи.
Задача № 1.
После первичной обработки в дезрастворе, медсестра погрузила инструменты в моющий раствор. Затем она извлекла инструменты, промыла их проточной водой и провела дальнейшие этапы предстерилизационной обработке.
Какие ошибки допустила медсестра?
Задача № 2.
Медсестра проводила замачивание шприцев в моющем растворе после первичной обработки и с удивлением заметила, что раствор розового цвета.
Дальнейшая тактика медсестры?
Задача № 3.
Медсестра проводила обработку шприцев. Она взяла 975 мл дистиллированной воды, добавила 5гр « Лотос». Добавила 20 мл 33 % перекиси водорода, тщательно размешала и погрузила туда шприцы.
В чем ошибка медсестры?
Задача № 4.
При проверке предстерилизационной обработки шприцов на скрытую кровь амидопириновой пробы, раствор реактива приобрел сине- фиолетовое окрашивание.
Что это значит? Ваши дальнейшие действия.
Задача № 5.
Медсестра гинекологического отделения отправила в ЦСО (автоклав) медицинский инструментарий для стерилизации в открытых лотках. Медсестра ЦСО отказалась принять этот инструментарий. Как вы расцениваете тактику медсестры ЦСО?
Задача № 6
Медсестра процедурного кабинета приготовила для стерилизации шприцы. Для упаковки использовала крафт – пакет. В каждый крафт-пакет был уложен шприц в разобранном виде и игла. После упаковки медсестра отправила шприцы для автоклавирования.
Оцените правильность действия медсестры?
Задача № 7.
Пациент К., 40 лет.,страдающий острой пневмонией отказался от стационарного лечения. Лечение будет проводить в домашних условиях, инъекции антибиотиков будет делать жена. Участковая медсестра объяснила ей как кипятить шприцы. После использования воды из- под крана через 3 дня поршень стал двигаться с трудом по цилиндру.
Оцените тактику действий медсестры? Объясните возможность дальнейшего использования этого шприца?
Задача № 8.
Медсестра проводила замачивание шприцов в моющем растворе
«Биолот». После использования, медсестра отметила, что раствор не розовый, значит – можно использовать.
Оцените действия медсестры?
Задача № 9.
Вы работаете в ЦСО. Поступила упакованная партия шприцев (500 штук) из отделений для стерилизации. Вам необходимо проверить предстерилизационной очистки на скрытую кровь.
7. Задание на дом
Тема « Инфекционный контроль»
Подготовить ответы на вопросы:
Что такое стерилизация
Виды стерилизации
Укладка материала для стерилизации
Методы стерилизации
Контроль стерилизации
Эталоны ответов.
на претесты: на постесты:
7 этапов 1.а
а 2.в
однократно 3.б
5 4.в
г 5.в
г 6.б
б 7.I этап
а, в, б 8.в
III этап 9.а
в 10. ГОСТ -42-21-2-85
Ответы на задачи.
Пропущен этап ершевания.
Медсестра не должна замачивать шприцы в растворе с розовой окраски. Раствор нужно немедленно заменить на новый.
Медсестра не подогрела раствор до 55 0С.
При окрашивании реактива в сине- фиолетовый означает наличие в шприце крови. Необходимо повторить все этапы предстерилизационной обработки.
Правильно. Автоклавировать медицинский инструментарий в открытых емкостях нельзя.
В крафт — пакет вместе со шприцем укладываются 2 иглы для забора лекарства и для инъекции.
В результате использования воды из–под крана, соли, содержащиеся в воде, выпадают в осадок, откладываются на цилиндре и поршне, и делают шприц непригодным. Воды должна быть дистиллированной или прокипяченной.
Медсестра поступила неправильно. Моющий раствор « Биолот» используется однократно, так как фермент быстро разрушается.
Выборочно берется из разных отделений иглы и шприцы н6а лоток и капается из пипетки в цилиндр, на поршень и пропускаете через иглы свежеприготовленный реактив (азопирам). При появлении соответственно фиолетового цвета при окрашивании через минуту, реакция считается положительной. Предстерилизационную очистку всей партии необходимо повторить.
8. Список литературы.
Л.И.Кулешова; Е.В.Пустоветова «Инфекционная безопасность в ЛПУ» стр.197-212
Т.П. Обуховец « Основы сестринского дела» практикум, 2002 г. стр. 144-151
С.А. Мухина» Атлас по манипуляционной технике», 1996 г.
Дополнительная литература:
ГОСТ -42-21-2-85
Руководство к практическим занятиям по дезинфекционному делу» В.А. Вилькович, 1993 г
Пособие для работы ЛПУ по вопросам дезинфекции и стерилизации.
Обработка изделий медицинского назначения многократного применения
Актуальность.
Во всем мире внутрибольничные инфекции являются актуальной проблемой. По данным отечественных и зарубежных исследователей внутрибольничная инфекция (ВБИ) возникает как минимум у 5-12% пациентов, поступивших в лечебно-профилактичекое учреждение. Смертность от неё достигает 255, а у новорожденных ВБИ — основная причина смертности.
Внутрибольничные инфекции наносят огромный ущерб здравоохранению. Несмотря на колоссальные достижения в области лечебно-диагностических технологий, в частности, технологий стационарного лечения, проблема ВБИ остаётся в современных условиях одной из наиболее острых, приобретая все большую медицинскую и социальную значимость.
В структуре ВБИ ведущее место(75-80%), особенно в крупных городах, занимают гнойно-септические инфекции.
Цель занятия:
Изучить основные понятия «инфекция», «инфекционный процесс», «инфекционная болезнь»
Изучить методы профилактики и контроля за распространением внутрибольничной инфекции (ВБИ).
Изучить меры безопасности медицинского персонала от инфекции.
Изучить понятия «асептика», «антисептика», «деконтаминация», «дезинфекция», «стерилизация».
Изучить виды, методы дезинфекции и стерилизации.
Изучить способы контроля дезинфекции, предстерилизационной обработки, стерилизации.
Изучить способы обработки рук медицинского персонала (мед. сестра, хирург).
Научиться использовать медицинские перчатки.
Научиться обработке рук в зависимости от уровня деконтаминации.
Познакомиться с основными приказами по профилактика ВБИ
Антисептика.
Различают механическую, физическую, химическую, биологическую и смешанную антисептику.
Механическая и физическая антисептика.
В основе механической антисептики лежит метод хирургической обработки ран. Эту операцию выполняют в операционной: иссекают края, стенки и дно раны с целью удаления омертвевших и нежизнеспособных тканей, а вместе с ними микробной флоры. Это основной метод лечения случайных инфицированных ран.
Методы физической антисептики основаны на использовании законов капиллярности, диффузии, осмоса, принципа сифона и др.
Дренирование ран, гнойных очагов (абсцессы, эмпиемы) предусматривает создание условий для оттока раневого отделяемого во внешнюю среду. В качестве дренажа при лечении ран применяют марлевый тампон.
Для более эффективного промывания ран и гнойных полостей в них (кроме дренажа для оттока раневого отделяемого) вставляют другую трубку, через которую вводят раствор антибактериального препарата, вместе с которым продукты распада тканей, гной, кровь и фибрин удаляются из раны через дренажную трубку. Таким образом, комбинирую методы физической и химической антисептики, создают метод проточного диализа.
В тех случаях, когда дренируемая полость герметично применяют активную аспирацию (вакуумное дренирование).
Асептические условия в ране можно создать, поместив конечность с раной или больного в специальную камеру, в которой с помощью установки создают абактериальную среду.
Лазерное излучение в виде луча малой мощности обладает бактерицидным эффектом и не оказывает повреждающего действия на ткани.
Ультразвук низкой частоты оказывает бактерицидное влияние. В жидкой среде ультразвук проявляет физические и химические свойства.
Химическая антисептика.
Химические антибактериальные препараты используют для борьбы с инфекцией в ране, очагах воспаления, их применяют с лечебной или профилактической целью для получения антибактериального эффекта непосредственно в организме человека.
Производные нитрофурана: препараты эффективны в отношении гноеродной кокковой флоры (например фурацилин, применяют в водных растворах 1:5000 для промывания гнойных ран, фурагин, для тех же целей).
Группа кислот: для промывания ран, гнойных полостей или гнойных свищей используется 2-3% водный раствор борной кислоты, кислота салициловая обладает антибактериальным и кератолическим действием.
Окислители: к этой группе относятся перекись водорода и перманганат калия, которые при соединении с органическими веществами выделяют атомарный кислород, обладающий антимикробным действием.
Красители: бриллиантовый зеленый используется для смазывания поверхностных ран, ссадин, для лечения гнойных заболеваний кожи.
Метиленовый синий применяется для смазывания поверхностных ран и ссадин в виде 3% раствора, для лечения ожогов в виде 1-2% спиртового раствора.
Детергенты: хлоргексидин для промывания ран полостей при гнойном воспалении.
Сульфаниламидные препараты: являются активными противомикробными средствами по отношению у стрептококкам, гонококкам и др. К ним относятся: стрептоцид, сульфадимезин, этазол и др.
Соли тяжелых металлов: серебра нитрат – используется как антисептическое и противовоспалительное средство при лечении язв, трещин, избыточных грануляций.
Местное применение химиотерапевтических средств:
Использование повязок с антисептическими препаратами при лечении ран и ожогов.
Введение растворов антибактериальных препаратов в рану.
Инфильтрация очага воспаления раствором антибактериальных препаратов для борьбы с инфекцией в этом очаге.
Общее применение химиотерапевтических средств включает:
— прием антибактериальных препаратов внутрь с целью местного воздействия на микрофлору ЖКТ при подготовке больных к операции на кишечнике и общего действия на организм после всасывания в кровь
— внутривенное введение некоторых химиотерапевтических препаратов.
Биологическая антисептика
Для лечения и профилактики гнойно-воспалительных заболеваний применяются препараты биологического происхождения. Среди антибактериальных препаратов важное место занимают антибиотики. Применение их в современных условиях представляет значительные трудности, что обусловлено изменением видового состава и свойств микробной флоры – распространением лекарственной устойчивости микроорганизмов. Основные возбудители гнойно-воспалительных заболеваний приобрели высокую степень антибиотикорезистентности.
Основными антибиотиками, применение которых показано для лечения и профилактики воспалительных заболеваний являются следующие: пенициллины, цефалоспорины, аминогликозиды, тетрациклины.
Антибиотиками широкого спектра действия, оказывающими бактерицидное действие на флору, являются пенициллины, аминогликозиды и тетрациклины.
Протеолитические ферменты относятся к средствам биологической антисептики.
Ферментные препараты применяют при лечении гнойных ран, трофических язв. Препараты используют до полного очищения ран или язв. При лечении воспалительных инфильтратов ферменты применяют методом электрофореза.
Смешанная антисептика.
Воздействие перечисленных видов антисептики на микробную клетку и макроорганизм невозможно свести к единому механизму. Их действие в большинстве случаев комплексное.
Хирурги в своей работе стремятся получить максимальный антисептический эффект и, как правило, используют несколько видов антисептики, а иногда весь их арсенал.
Классическим примером практического использования смешанной антисептики является современная тактика лечения ран. Первичная хирургическая обработка ран (механическая и химическая антисептика), как правило, дополняется использованием гипертонических растворов, марлевых повязок и др., т.е. физической антисептикой.
Предупреждение эндогенного инфицирования ран.
Профилактику инфицирования раны во время операции из эндогенных источников проводят различными методами. Предупреждение контактного инфицирования предусматривает тщательное выполнение техники оперативного вмешательства. Чтобы уменьшить возможность переноса микробной флоры в зону оперативного вмешательства, больному назначают антибиотики, непосредственно перед операцией, во время операции после ее окончания. Принимают обязательнее меры по предупреждению контактного инфицирования во время операции, если очаг хронической инфекции находится в зоне операции.
Нормативные документы ОСТ 42-21-85 «Стерилизация и дезинфекция изделий медицинского назначения. Методы, средства, режимы»; Методические указания по дезинфекции, предстерилизационной очистке и стерилизации изделий медицинского назначения» №МУ-287-113 от 30.12.98 г.
Инструменты, после их использования, делятся на 3 группы:
1 группа – критические инструменты – инструменты, соприкасающиеся с раневой поверхностью, кровью, инъекционными препаратами (пинцеты, карцанги, скальпели, шприцы, иглы и т.д.).
2 группа– условно-критические инструменты – инструменты, соприкасающиеся со слизистыми, которые могут быть ими ранены (нарушение целостности слизистых). Это шпатели, глазные пипетки, зонды дуоденальные, назогастральные, мочевые катетеры, наконечники, эндоскопы и т.д.
3 группа– некритические инструменты – инструменты, соприкасающиеся с неповрежденной кожей или слизистыми (термометры, манжетки от тонометров, грелки, пузыри для льда, судна, мочеприемники, мензурки и т.д.).
Инструменты 1 и 2 групп должны быть стерильными, поэтому проходят три этапа обработки:
1 этап – дезинфекция
2 этап – предстерилизационная очистка
3 этап – стерилизация
Инструменты 3 группы проходят один этап обработки – дезинфекцию.
I этап обработки – дезинфекция
Дезинфекция– комплекс мероприятий, направленных на уничтожение патогенных и условно патогенных возбудителей на поверхности изделий медицинского назначения.
Дезинфекции подлежат все изделия после применения у пациента.
Методы дезинфекции.
Механический 0 удаление возбудителей с поверхностей предметов путем мойки, стирки, вытряхивания, выколачивания, проветривания, собирания пыли пылесосом.
Физический – удаление возбудителей воздействием высокой температуры (кипячение, горячий воздух), УФО.
Химический – удаление возбудителей воздействием химических препаратов (протирание, орошение, замачивание в дезинфицирующих растворах). При обработке с дезинфицирующими растворами необходимо помнить – дезинфицирующие растворы – это яд, поэтому:
Емкости с дезинфицирующими растворами должны быть закрыты.
С дезинфицирующими растворами необходимо работать в специальной одежде (4-х слойная маска, защитные очки, резиновые технические перчатки).
Дезинфицирующие растворы должны быть менее токсичными, т.е. 4-й катекогии токсичности.
Комбинированный – мойка, затем замачивание в дезинфицирующих растворах (эндоскопическое оборудование).
Выбор метода дезинфекции зависит от особенностей изделия и его назначения.
Уровни дезинфекции.
Низкий уровень дезинфекции или социальный. Цель – уничтожение бактерий. К нему относятся: дезинфекция изделий с дезинфицирующими растворами низкой концентрации. Например, 1% раствор хлорамина, 3% раствор перекиси водорода.
Средний уровень дезинфекции. Цель – уничтожение ВИЧ, ВГ, ОРВИ, сифилиса. Например, 3% раствор хлорамина, 4% раствор перекиси водорода.
Высокий уровень дезинфекции – использование дезинфицирующих растворов высокой концентрации, способных уничтожить возбудителей туберкулеза, гнойных инфекций, кандидоза, анаэробных инфекций (столбняк, газовая гангрена, сибирская язва). Например, 5% р-р хлорамина, 6% р-р H2O2+ 0,5% р-р МС.
Режим дезинфекции– это концентрация дезинфицирующего раствора или высокая температура и экспозиция, способствующие уничтожению возбудителей.
Выбор уровня и режима дезинфекции зависит от стойкости возбудителя во внешней среде.
