правила проведения и оценки результата :: BusinessMan.ru
Амидопириновая проба – один из методов контроля предстерилизационной очистки медицинских инструментов. После применения моющих растворов на медицинских инструментах не должно оставаться следов белка, жира, крови и других загрязнений. Определить это невооруженным глазом невозможно: на помощь приходят химические реакции. Амидопириновая проба позволяет с точностью определить наличие скрытой крови. В статье рассмотрим правила и порядок ее проведения.
Реагенты
Раствор для амидопириновой пробы может изготавливаться непосредственно перед применением или же заранее. Поместив смесь во флакон с притертой пробкой в холодильник, ее можно хранить на протяжение одного месяца. Это достаточно удобно: не нужно каждый раз тратить время на приготовление раствора.
Для проведения амидопириновой пробы необходимы следующие вещества:
- раствор перекиси водорода 3%;
- раствор уксусной кислоты 30%;
- спиртовой раствор амидопирина 5%.

Перед использованием следует проверить срок годности каждого из реагентов. Дополнительно для проведения реакции понадобятся: мензурка, лоток с сухими инструментами, приготовленными для пробы, лоток с ватными тампонами и пипетки. Все используемые емкости должны быть стерильны.
Метод приготовления и использования
Амидопириновая проба довольно легко проводится: не требуется никаких особых навыков, только четкое следование инструкции. Приготовив все реактивы, емкости и приспособления, следует приступить к процедуре. Для этого используется следующий алгоритм:
- В равных количествах смешать реагенты: уксусную кислоту (р-р 30%), перекись водорода (р-р 3%), амидопирин (спиртовой р-р 5%). При этом каждое из веществ набирать отдельной промаркированной для этих целей пипеткой. Например, пипетка для раствора перекиси водорода должна быть отмечена как «Для Н2О2».
- Раствор перемешать. Получается бесцветная жидкость. Взяв отдельную пипетку («Для реактива»), набрать смесь и нанести на сухие предметы, которые прошли предстерилизационную очистку. Раствор капать равномерно по всей площади исследуемого инструмента, в том числе на корпус, во внутреннюю полость, в просвет иглы и т. д.
- Держать предмет над стерильной салфеткой или ватой, внимательно наблюдать за тем, какого цвета раствор стекает с инструмента.
- Для проверки очистки многоразовых шприцев раствор набирают в него и медленно по капле выдавливают на чистую салфетку, наблюдая за изменением оттенка.
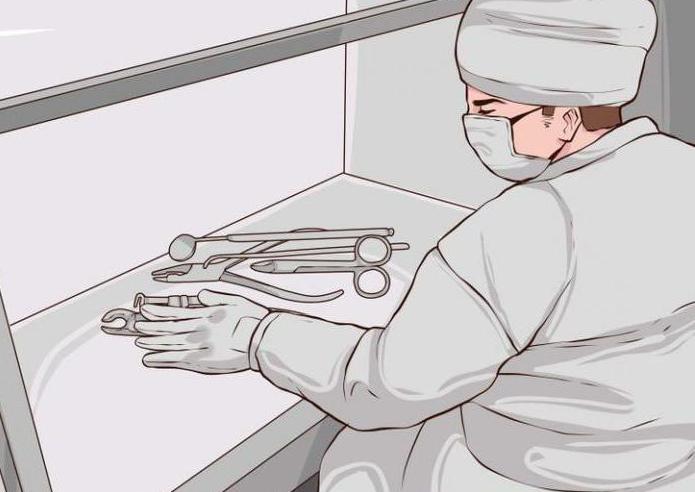
На данном этапе важно соблюсти правила стерильности всех используемых для приготовления и нанесения раствора инструментов. Результаты пробы не должны быть искажены, потому как для соблюдения правил асептики необходима, в частности, амидопириновая проба. Инфекции, которые могут содержаться в остатках крови, нередко становятся серьезной угрозой для жизни и здоровья населения.
Завершение пробы
После нанесения реагента на инструменты в течение минуты необходимо оценить результат. Если за 60 секунд произошло окрашивание, проба считается положительной. Изменение цвета в промежуток времени после 1 минуты не засчитывается. Положительная амидопириновая проба определяется в том случае, если раствор окрасился в фиолетовый (сине-зеленый) цвет. Отрицательная – если оттенок раствора не изменился после нанесения его на инструментарий.

После получения результатов в случае обнаружения остатков крови (положительная проба) всю партию инструментов снова подвергают предстерилизационной очистке. Если цвет жидкости не изменился, то проверяемый инструмент опускают в мыльный раствор. Затем всю партию направляют на стерилизацию установленным методом.
Амидопириновая проба действие оказывает подобно индикатору, она чувствительна к компонентам крови. К проведению предстерилизационной очистки выдвигается ряд требований. На инструментах не должно оставаться следов жира, крови, мыльного раствора и других посторонних веществ. Проверить качество очистки помогают различные пробы. Амидопириновая — одна из них.
Контроль предстерилизационной обработки: амидопириновая, азопирановая пробы
Фенолфталеин в щелочной среде
Азопирановая проба
Проводится на наличие гемоглобина, окислителей, хлорсодержащих средств, стирального порошка, ржавчины.Состав азопирама:
100 мл амидопирина;
1 мл солянокислого анилина
Смешать в сухой посуде и залить 96%. спиртом до 1 литра. Смесь тщательно перемешать палочкой до полного растворения всех ингредиентов.
Хранить в плотно закрытом флаконе при температуре +4 С (в холодильнике) в течение 2 месяцев, при температуре от + 18 С до 4 — 20 ° С в течение 1 месяца.
ВНИМАНИЕ! Умеренное пожелтение реактива в процессе хранения без выпадения осадков не снижает его рабочих качеств.
Смешивают в равных количествах азопирам и 3% раствор перекиси водорода (азопирамовая проба проводится так же, как амидопириновая). Реакция в течение 1 минуты.
При положительной реакции окрашивание:
сине-фиолетовое — наличие крови;
бурое — наличие хлор содержащих окислителей, ржавчина;
розовое — наличие моющего средства.
Температура исследуемого изделия от + 18 ° С до от +25 0 С. Рабочий раствор азопирама с перекисью водорода должен быть использован в течение 2 часов
Амидопириновая проба
Проводится на наличие КРОВИ.Состав смеси:
5% спиртовой раствор амидопирина,
30% раствор уксусной кислоты,
3% раствор перекиси водорода.
Смешать в отдельной емкости в равных количествах все перечисленные ингредиенты.
Нанести смесь на инструмент в места, соприкасающиеся с раневой поверхностью, в места соединения подвижных частей инструмента. Индикация загрязнений, присутствия следов крови происходит немедленно или не позднее, чем через 1 минуту после контакта реактива с загрязненным участком. В данном месте появляется фиолетовое (сине-зеленое) окрашивание.
Рабочий раствор готовят непосредственно перед применением.
Внимание! При получении положительной реакции амидопириновой или азопирамовой пробы всю партию изделий медицинского назначения стерилизуют, а инструмент, на котором проводилась, проба промывают под проточной водой и помещают в емкость с моющим раствором для повторной обработки
Фенолфталеиновая проба
Качество отмывания с поверхности инструмента активных веществ моющего средства проверяют реакцией спиртового раствора фенолфталеина. Нанести 2-3 капли раствора на инструмент (на места соприкосновения инструмента с раневой поверхностью и на места соединения подвижных частей инструмента). При появлении розового окрашивания, свидетельствующего о наличие неотмытых веществ, всю партию изделий промывают повторно проточной водой, затем дистиллированной. Инструмент, на котором проводилась проба, промывают проточной водой от реактива и помещают в емкость с моющим раствором для повторной предстерилизационной очистки.При проверке качества очистки игл, реактив набирают в чистый, не имеющий следов коррозии шприц, и, последовательно меняя иглы, пропускают реактив через них, выдавливая 3-4 капли на марлевую салфетку. Затем, для более тщательного контроля, на чистую иглу накручивают маленький кусочек ваты, смоченный реактивом, и протирают наружную часть иглы.
Качество очистки катетеров или других полых изделий оценивают путем введения реактива внутрь изделий с помощью чистого шприца или пипетки. Реактив оставляют внутри изделия в течение 0,5-1 минуты. После этого его сливают на марлевую салфетку. В лечебно-профилактических учреждениях ежедневному контролю подвергают 1-4% предметов медицинского назначения из каждой обработанной партии, но не менее 3-5 единиц. Результаты заносят в журнал.
Стерилизацию предметов медицинского назначения проводят различными методами: паром, сухим горячим воздухом, растворами химических веществ. Выбор того или иного метода стерилизации зависит от особенностей стерилизуемого объекта
Смотрите также
Амидопириновая проба
5% раствор амидопирина хранится во флаконе с притертой пробкой в холодильнике в течение 1 месяца.
-5% спиртовой раствор амидопирина (готовят в 95% этиловом спирте
-30% раствор уксусной кислоты (готовят на дистиллированной воде)
-3% раствор перекиси водорода (готовят на дистиллированной воде)
Результат читается в течение 1 минуты, не более.
При положительном результате появляется фиолетовое окрашивание.
Фенолфталеиновая проба
1% спиртовой раствор фенолфталеина хранится в холодильнике в течение 1 месяца.
Результат читается в течение 1 минуты, не более.
Внимание! Реакция не учитывается, если прошло более 1 минуты.
При положительном результате появляется розовое окрашивание. Поэтому вся группа проверяемых изделий, из которых отбирался контроль, подвергается повторной обработке – промыванию проточной и дистиллированной водой.
Проба с суданом-3
В 70 мл нагретого до 600 С (на водяной бане) 95% этилового спирта растворяют по 0,2г измельчённой краски судана 3 и метиленового синего. Затем добавляют 10 мл 20 – 25% раствора аммиака и 20 мл дистиллированной воды. Готовый раствор хранится в холодильнике в плотно закрытом крышкой флаконе в течение 6 месяцев.
В шприц набирают 3 – 5мл раствора, смачивают всю поверхность в течение 10 секунд, краску смывают обильной струёй воды. Наличие желтых пятен и подтеков свидетельствует о том, что инструмент загрязнён и подлежит повторно предстерилизационной очистке.
Дополнительная информация
Для контроля трудно доступных мест применяют ватные турунды, смоченные в реактиве.
Для проверки шприца в него наливают реактив и несколько раз продвигают поршень, смачивая стенки, а затем вытесняют реактив на марлевую салфетку или вату.
Иглы на остатки крови, щелочи, жира проверяют шприцом, который уже прошел контроль на пробы и не дал положительную реакцию.
Для проверки катетеров и полых изделий в них вводят реактив пипеткой (или чистым поршнем), затем сливают на марлевую салфетку.
При положительной пробе на кровь, жировое загрязнение или моющее средство всю группу контролируемых изделий подвергают повторной очистке (до получения отрицательных результатов). Контролю подвергают 1-3% каждого наименования изделий, отработанных за сутки, а в ЦСО – за 1 смену.
Обработка инструментов, полученных со склада.
1.Замочить в горячей воде (50-600 С) для размягчения смазочного материала (масла).
2.Очистить чистой тряпкой смазку до полного удаления, разобрав инструмент на составные части (не перепутать детали).
3.Замочить очищенные инструменты на 15-20 минут в горячем растворе 1% моющего средства.4.Ополоснуть или протереть тряпочкой, смоченной в керосине или ацетоне, добиваясь полного удаления остатков смазки.
5.Очищенные до блеска инструменты кипятить в 2% растворе натрия бикарбоната (соды) или в 1% моющем растворе и вновь протереть чистой тряпочкой.
6.При необходимости обработку керосином или ацетоном повторить.
Амидопириновая проба
Цель:
-провести комплексный контроль качества предстерилизационной очистки инструментов медицинского назначения от гемоглобина
-оценить эффективность работы моечных машин в ЦСО
Показания:
-в ЦСО — ежедневно
-самоконтроль в отделении – 1 раз в неделю
-центр санэпиднадзора контролирует ЛПУ – 1 раз в квартал
Противопоказаний:
нет
Сестринские вмешательства:
-независимое
Безопасность медицинской сестры на рабочем месте:
-использование средств индивидуальной защиты: маски, очков, латексных перчаток
-работа в помещении, оснащённом вентиляцией
Оснащение:
-5%-ный спиртовый раствор амидопирина
-3% перекись водорода
-30%-ный раствор уксусной кислоты
-пипетки с маркировкой:
«5%-ный спиртовый раствор амидопирина»
«3%-ный раствор перекиси водорода»
«30%-ный раствор уксусной кислоты»
«рабочий раствор амидопирина»
-емкость с маркировкой «рабочий раствор амидопирина»
-лотки с сухим холодным инструментарием, прошедшим предстерилизационную очистку (1% изделий одного наименования, но не менее 3-5 шт.)
-лотки с марлевыми салфетками
-часы с секундной стрелкой (или песочные), секундомер
-емкость для хранения пипеток
-журнал учета результатов контроля предстерилизационной очистки
Порядок действий:
Вымыть руки, надеть маску, очки, перчатки.
Приготовить рабочий раствор амидопирина:
-открыть флакон с 5%-ным спиртовым раствором амидопирина, взять пипетку с маркировкой «5%-ный спиртовый раствор амидопирина», набрать определенное количество реактива в пипетку, выпустить раствор из пипетки в емкость с маркировкой «рабочий раствор амидопирина»;
-поставить пипетку в специальную емкость для хранения пипеток. Закрыть флакон с 5%-ным спиртовым раствором амидопирина;
-открыть флакон с 3%-ным раствором перекиси водорода, взять пипетку с маркировкой
«3%-ный раствор перекиси водорода», набрать раствор в том же количестве, как амидопириновый реактив, выпустить раствор в емкость с маркировкой «рабочий раствор амидопирина»;
-открыть флакон с 30%-ным раствором уксусной кислоты, взять пипетку с маркировкой
«30%-ный раствор уксусной кислоты», набрать раствор в том же количестве, как амидопириновый реактив, выпустить раствор в емкость с маркировкой «рабочий раствор амидопирина»;
-смешать ингредиенты приготовленного рабочего раствора амидопирина, закрыть раствор.
Подготовить необходимые инструменты в разобранном виде для постановки пробы.
Взять пипеткой с маркировкой «рабочий раствор амидопирина» небольшое количество раствора.
Нанести его на предмет, в полости инструмента, резьбу зажима, в места соприкосновения с биологическими жидкостями.
Внимание! Инструменты брать только холодные (не выше 25 градусовС).
Держать предмет или инструментарий над салфеткой, наблюдая за цветом стекающего реактива.
Оценить результат.
Независимо от результата пробы (даже при отрицательной пробе) инструментарий, использованный для пробы, промыть водой или спиртом, затем провести предстерилизационную очистку.
Результаты пробы записать в журнал учета.
Примечание:
Проба считается положительной, если цвет реактива изменился в течение первой минуты. Если цвет изменился позже, чем через одну минуту, то проба не засчитывается.
Если цвет реактива изменился на сине — фиолетовый, то это свидетельствует о наличие крови на предметахПри положительной пробе вся партия изделий одного наименования подлежит повторной очистке.
Проба считается отрицательной, если цвет реактива не изменился.
Методы проведения проб на скрытую кровь Амидопириновая проба
• Приготовление раствора. Смешивают равные количества 5% спиртового раствора амидопирина, 30% уксусной кислоты и 3% раствора перекиси водорода (по 2-3 мл).
• Техника проведения. На стерильную вату наносят полученную смесь и протирают поршень шприца, цилиндр с наружной стороны, иглы, канюлю внутри. Затем заливают реактивы в цилиндр шприца, пропускают их через шприц на вату, проверяя цилиндр. Надевают иглу и делают то же самое, проверяя иглу. При наличии крови на вате появляется сине-зеленое окрашивание. Оно может появиться и при реакции на тройной раствор, хлорамин, лекарственные вещества.
Азопирамовая проба
• Техника проведения. Готовят 1,0-1,5% раствор солянокислого анилина в 95% растворе спирта этилового. Его хранят в холодильнике до 2 месяцев, вне холодильника — не более месяца. Перед постановкой пробы смешивают равные объемы азопирама и 3% раствора перекиси водорода.
• Техника проведения. Смесь использовать в течение 1-2 ч. Не проверять горячие инструменты, не держать раствор возле нагревательных приборов и на ярком свету. При попадании реактива на кровь в течение 1 мин появляется фиолетовое окрашивание.
Инструменты, после операции у больных с анаэробной инфекцией, дезинфицируют в 6% растворе перекиси водорода в течение 60 мин, а затем они проходят стандартную предстерилизационную подготовку, как и другие инструменты.
Укладка и подготовка к стерилизации
Инструменты стерилизуют воздушным (в сухожаровых шкафах), паровым (автоклавирование) и химическим методами. Для стерилизации в сухожаровых стерилизаторах инструменты помещают в металлические коробки (при снятых крышках, крышки стерилизуют рядом) или в упаковку из бумаги мешочной непропитанной (закладывают уже высушенные инструменты), или выкладывают их на специальные решетки стерилизатора и производят просушку инструментов при температуре — 80-85 °С, при открытой дверце стерилизатора, до полного испарения влаги с инструментов (рис. 4-2, рис. 4-3). Для стерилизации паром под давлением инструменты кладут в металлические биксы (выстланные двухслойной хлопчатобумажной простынкой (рис. 4-4, рис. 4-5) или двойные полотняные мешки (изготовленные из бязи).

Рис. 4-2. Общий вид сухожарового стерилизатора

Рис. 4-3. Общий вид сухожарового стерилизатора с хирургическими инструментами на решетках стерилизатора (с целью просушки)

Рис. 4-4. Общий вид загруженного металлического бикса

Рис. 4-5. Общий вид загруженного биксами парового стерилизатора
Перед химическим методом стерилизации хирургические инструменты, после предстерилизационной обработки, выкладывают на чистые простыни и производят просушку при комнатной температуре до полного испарения влаги с поверхностей инструментов.
Стерилизация хирургических инструментов
Инструментарии для медицинских манипуляций по риску имеют следующие различия.
• Критические — проникают в стерильные ткани или сосуды: имплантаты, скальпели, иглы, другие хирургические инструменты и т.д. Стерилизация — спороцидные химические вещества, длительный контакт.
• Полукритические — соприкасаются со слизистыми оболочками (за исключением стоматологических инструментов): гибкие эндоскопы, ларингоскопы, эндотрахеальные трубки, а также другие аналогичные инструменты. Дезинфекция высокого уровня — спороцидные химические вещества, кратковременный контакт.
Термометры, ванны для гидротерапии. Дезинфекция среднего уровня — больничные дезинфицирующие средства с указанием в маркировке о наличии туберкулоцидной активности.
• Некритические — (соприкасаются с неповрежденной кожей): стетоскопы, настольные приборы, подкладные судна и др. Дезинфекция низкого уровня — больничные дезинфицирующие средства без указания в маркировке о наличии туберкулоцидной активности.
Стерилизация хирургических инструментов осуществляется несколькими методами: воздушным (сухожаровые шкафы), паровым (автоклавирование) и химическим.
Воздушный — производится в воздушных стерилизаторах, которые находятся в стерилизационной комнате операционного блока или перевязочных хирургических отделений (рис. 4-6, рис. 4-7), по двум режимам:
• при 180 °С (+2 °С или -10 °С) в течение 60 мин;
• при 160 °С (+2 °С или -10 °С) в течение 150 мин.

Рис. 4-6. Общий вид воздушного стерилизатора снаружи

Рис. 4-7. Общий вид воздушного стерилизатора внутри
Оба режима рекомендуются для изделий из металла, стекла и силиконовой резины.
Паровой — производится в паровых стерилизаторах (рис. 4-8, рис. 4-9), которые располагаются в специальном помещении — автоклавной, по «основному» режиму стерилизации:
• при 132 °С (±2 °С) под давлением 2 атм. (0,2 МПа) в течение 20 мин.
Данный режим стерилизации рекомендуется для изделий коррозийно-стойкого металла, стекла, изделий из текстильных материалов.
Химический — проводится при полном погружении в раствор в закрытых емкостях из пластмассы или покрытых эмалью на время стерилизационной выдержки, после чего изделие должно быть промыто стерильной водой.

Рис. 4-8. Общий вид парового стерилизатора снаружи

Рис. 4-9. Общий вид парового стерилизатора внутри
Этапы предстерилизационной очистки
Дезинфекция медицинских изделий путем погружения в
3% растор хлорамина или 1% раствор гипохлорита кальция на 60 мин, или раствор Пресепта на 90 мин. Перчатки после операции дезинфи-цируются путем погружения их в 3% раствор хлорамина или 6% перекись водорода на 1 час.
Тщательное промывание изделий под проточной водой,
удаляя все загрязнения щетками. Изделия с каналами и полостями промывают с помощью шприцев, резиновых баллонов и пр..
3. Замачивание изделий в разобранном виде с заполнением каналов и полостей в горячем моющем растворе /температура 40% — 50% C/ в течение 15 минут. В процессе обработки температура моющего раствора не поддерживается.
Для замачивания могут использоваться:
0.5% моющий раствор порошка «Билот» /5 г порошка и 995 мл воды температуры 40% — 45% C/;
раствор, содержащий 5 г моющего средства /»Прогресс», «Астра», «Лотос»/ + 20 мл 33% раствора перекиси водорода /пергидроль/ + 975 мл воды температуры 50-55% С;
3% натрий двууглекислый /питьевая сода/;
0,5% перекись водорода с моющими средствами «Лотос», «Лотос-автомат», «Астра», «Айна», «Маричка», «Професс». К этому комплексу добавляется ингибитор коррозии – 0,14% раствор олеата натрия. Моющий комплекс с перекисью водорода можно использовать в течение суток до 6 раз с момента приготовления при условии, что цвет раствора не изменился. Другие моющие растворы используются однократно.
4. Кипячение в течение 15 мин. при полном погружении изделий в один из следующих растворов:
сода питьевая 2%;
моющие средства «Лотос», «Лотос-автомат» 1,5%.
При использовании кипячения предстерилизационная очистка объединяется в один процесс с дезинфекцией.
5. Мойка инструментов в использовавшемся моющем растворе ершами или ватно-марлевыми тампонами в течение 0,5 минуты. Изделия с внутренними каналами промывают с помощью шприцев или баллонов, иглы прочищают мандренами. Механизированная предстерилизационная очистка медицинских изделий с использованием моечных машин и ультразвуковых установок мо-жет производиться только с применением разрешенных для этих целей препаратов в соответствии с инструкцией, прилагаемой к оборудованию.
6. Промывание инструментов под проточной водой для уда-ления остатков моющих средств. При использовании порошка «Биолот» в течение 3 минут, «Прогресс» — 5-6 минут, «Бланизол» — 5 минут, «Астра» и «Лотос» – 10 минут, натрий двууглекистый — 50 минут.
7. Ополаскивание изделий в дистиллированной воде в тече-ние 0,5-1 минуты для обессоливания.
Подсушка инструментария — проводится в сухожаровом
шкафу при температуре 80-90 гр.С в течение 15-20 мин. /до полного исчезновения влаги при визуальном контроле/.
2.1.1. Контроль качества предстерилизационной очистки.
Проводится после завершающего этапа предстерилизационной очистки — подсушивания инструментов. Выполняют пробы на наличие остатков крови и моющих средств на инструментах, шприцах, иглах и пр.
Для выявления остатков крови проводят амидопириновую или азопирамовую пробы, а, если это невозможно, — бензидиновую или ортотолидиновую пробы.
Амидопириновая проба.
Смешивают равные количества 0,5% спиртового раствора амидопирина, 30% уксусной кислоты и 3% раствора перекиси водорода /по 2-3 мл/.
На нестерильную вату наносят вышеказанный реактив. Через несколько секунд при отсутствии цветовой реакции на вате, этой ватой протирают инструменты или поршень щприца многоразового использования, цилиндр с наружной стороны, иглы, канюлю внутри. Затем заливают реактив в цилиндр шприца, пропускают его через шприц на другую вату /проверяется цилиндр шприца/.
После этого закрепляют на шприце иглу, вновь наливают в цилиндр реактив и пропускают через шприц и иглу /проверяется игла/.
Оценка результатов амидопириновой пробы.
при наличии кровяных загрязнений на вате появляется сине-зеленое окрашивание; окрашивание может быть и при наличии на шприце, а также в игле, лекарственных средств и хлорамина;
при положительных пробах повторный контроль инструмента проводят до получения трехкратного отрицательного результата.
/Из методических рекомендаций по предстерилизационной очистке изделий медицинского назначения N 28 — 6/13 от 08.06.82 г/.
Азопирамовая проба.
Готовят в аптеке 1% или 1,5% раствор солянокислого анилина в 95% этиловом спирте. Готовый раствор может храниться в плотно закрытом флаконе в темноте /в холодильнике/ 2 месяца, в комнате при температуре + 18-23 гр.С не более одного месяца. Умеренное пожелтение реактива, наступающее в процессе хранения, без выпадения осадка не снижает его рабочих качеств. Непосредст-венно перед постановкой пробы готовят рабочий раствор, смешивая равные по объему количества азопирама и 3% перекиси водорода. Рабочий раствор должен быть использован в течение 1-2 часов. При более длительном хранении может появиться спонтанное розовое окрашивание реактива. При температуре +25 гр.С. раствор розовеет быстрее. Поэтому его наиболее целесообразно использовать в течение 30-40 минут после приготовления. Из-за изменения окраски раствора в условиях высокой температуры нельзя держать его на ярком свете, вблизи отопительных приборов, наносить на горячие инструменты.
Пригодность рабочего раствора азопирама проверяют при необходимости путем нанесения 2-3 его капель на кровяное пятно. Если не позднее чем через 1 мин. появляется фиолетовое окра-шивание, переходящее в сиреневый цвет — реактив пригоден к применению. Если окрашивание в течение 1 минуты не появляется — реактивом пользоваться нельзя.
/Выписка из инструктивно-методических рекомендаций по контролю качества предстерилизационной очистки изделий меди-цинского назначения с помощью реактива азопирам N 28-6/13 от 26.05.86 г./.
Бензидиновая проба.
Не позднее чем за 2 часа до проведения пробы готовят реактив. В мезурку помещают несколько кристаллов бензидина, 2-3 мл 50% уксусной и кислоты столько же 2% раствора перекиси водорода.
Ортолидиновая проба.
Состав реактива: 2-3 мл 50% уксусной кислоты, 0,25 г орто-лидина и 2-3 мл 3% перекиси водорода.
Проверка качества предстерилизационной обработки
Проверка качества предстерилизационной обработки проводится путем постановки проб на наличие остатков крови (амидопириновая, азопирамовая и бензидиновая пробы) и
полноту отмыва изделий от щелочных компонентов моющих средств (фенолфталеиновая проба).
Ежедневному контролю подлежит 1% от каждого вида изделий, обработанных за сутки, но не менее 3-5 единиц.
Результаты контроля отражаются в журнале
учета качества предстерилизационной обработки ф.№ 366.
Азопирамовая проба
Перед постановкой пробы смешать равные количества азопирама и 3% перекиси водорода и работать далее этим реактивом в течение 1-2 часов.
Оценка результатов пробы (результат учитывается до истечения 1 минуты):
наличие ржавчины или остатков хлорсодержащих дезсредств (чтобы дифференцировать нужно дополнительно поставить йодо-крахмальную пробу).
Если в тот же срок – фиолетовое, синее или розово-сиреневое окрашивание, это означает наличие на инструментах остатков щелочи от моющего раствора
или
наличие остатков крови (чтобы отличить
необходимо дополнительно поставить фенолфталеиновую пробу).
Готовый раствор азопирама может храниться
в плотно закрытом флаконе в темном месте в холодильнике — 2 месяца, а при
комнатной температуре — не более 1 месяца.
Умеренное пожелтение раствора без выпадения осадка не снижает его рабочего качества.
Азопирамовая проба чувствительнее в 10 раз амидопириновой пробы.
Амидопириновая проба
Перед постановкой смешивают равные количества
5% спиртового р-ра амидопирина, 30% р-ра уксусной кислоты и 3% р-ра перекиси водорода.
На контролируемое изделие наносят 2-3 капли реактива.
Оценка результатов пробы: при наличии остатков крови возникает сине-зеленое окрашивание.
Спиртовой раствор амидопирина хранится во флаконе с притертой пробкой в течение 1 месяца.
Бензидиновая проба
Существуют две модификации пробы.
Проба с солянокислым бензидином.
Смешивают 0,5-1 % р-р солянокислого бензидина, приготовленного на дистиллированной воде, с равным количеством
3% перекиси водорода.
Проба с сернокислым бензидином.
В раствор, состоящий из
6 мл 50% уксусной кислоты и растворенных в ней 0,025 г сернокислого бензидина,
добавляют
5 мл 3% перекиси водорода.
На инструмент наносят 3 капли реактива, при наличии следов крови бесцветный реактив окрашивается в сине-зеленый цвет.
Йодокрахмальная проба
Для приготовления пробы к 100 г остуженного 1% крахмального клейстера добавляют
3 г йодистого калия, растворенного в 15 мл дистиллированной воды.
При наличии остатков хлорсодержащих препаратов проба меняет свой цвет с
бесцветной на бурый или синий
в течение 24 часов с момента проведения дезинфекции.
Готовый йодокрахмальный раствор хранится при комнатной температуре в течение 7-10 дней.
Партия изделий подлежит при положительной пробе
азопирамовой, амидопириновой, бензидиновой или йодокрахмальной –
повторной предстерилизационной обработке,
повторной отмывке водопроводной и дистиллированной водой.
