Этилацетат — Википедия
| Этилацетат | |||
|---|---|---|---|
| |||
| Хим. формула | C4H8O2 | ||
| Рац. формула | CH3-COO-CH2-CH3 | ||
| Молярная масса | 88,11 г/моль | ||
| Плотность | 0,902 г/см³ | ||
| Поверхностное натяжение | 25,13 ± 0,01 мН/м[3], 23,39 ± 0,01 мН/м | ||
| Динамическая вязкость | 0,578 ± 0,001 мПа·с[4], 0,423 ± 0,001 мПа·с[4], 0,325 ± 0,001 мПа·с[4] и 0,259 ± 0,001 мПа·с[4] | ||
| Энергия ионизации | 10,01 ± 0,01 эВ[1] | ||
| Температура | |||
| • плавления | −84 °C | ||
| • кипения | 77 °C | ||
| • вспышки | 24 ± 1 °F[1] и −4 ± 1 °C[2] | ||
| Пределы взрываемости | 2 ± 1 об.%[1] и 2 ± 0,1 об.%[2] | ||
| Давление пара | 73 ± 1 мм рт.ст.[1], 10 ± 1 кПа[5], 12,6 ± 0,1 кПа[6] и 100 ± 1 кПа[5] | ||
| Показатель преломления | 1,3720 | ||
| Дипольный момент | 1,78 ± 0,09 Д[7] | ||
| Рег. номер CAS | 141-78-6 | ||
| PubChem | 8857 | ||
| Рег. номер EINECS | 205-500-4 | ||
| SMILES | |||
| InChI | |||
| Кодекс Алиментариус | E1504 | ||
| RTECS | AH5425000 | ||
| ChEBI | 27750 | ||
| ChemSpider | 8525 | ||
| Токсичность | малотоксично | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 | |||
Этилацетат (этиловый эфир уксусной кислоты) СН3−СОО−CH2−CH3 — бесцветная летучая жидкость с резким запахом.
Этилацетат образуется при прямом взаимодействии этанола с уксусной кислотой (реакция этерификации):
- Ch4COOH+C2H5OH→Ch4COOC2H5+h3O{\displaystyle {\mathsf {CH_{3}COOH+C_{2}H_{5}OH\rightarrow CH_{3}COOC_{2}H_{5}+H_{2}O}}}
Лабораторный метод получения этилацетата заключается в ацетилировании этилового спирта хлористым ацетилом или уксусным ангидридом:
- Ch4COCl+C2H5OH→Ch4COOC2H5+HCl{\displaystyle {\mathsf {CH_{3}COCl+C_{2}H_{5}OH\rightarrow CH_{3}COOC_{2}H_{5}+HCl}}}
К промышленным способам синтеза этилацетата относятся:
- Перегонка смеси этилового спирта, уксусной и серной кислот.
- Обработка этилового спирта кетеном.
- Дегидратация этилового спирта при повышенных температурах и давлении [8].
- Синтез по реакции Тищенко из ацетальдегида при 0-5 °C в присутствии каталитических количеств алкоголята алюминия:
- 2Ch4CHO→Ch4COOC2H5{\displaystyle {\mathsf {2CH_{3}CHO\rightarrow CH_{3}COOC_{2}H_{5}}}}
Бесцветная подвижная жидкость с резким запахом эфира. Молярная масса 88,11 г/моль, температура плавления −83,6 °C, температура кипения 77,1 °C, плотность 0,9001 г/см³, n204 1,3724. Растворяется в воде 12 % (по массе), в этаноле, диэтиловом эфире, бензоле, хлороформе; образует двойные азеотропные смеси с водой (т. кип. 70,4 °C, содержание воды 8,2 % по массе), этанолом (71,8; 30,8), метанолом (62,25; 44,0), изопропанолом (75,3; 21,0), CCl4 (74,7; 57), циклогексаном (72,8; 54,0) и тройную азеотропную смесь Э.: вода: этанол (т. кип. 70,3 °C, содержание соотв. 83,2, 7,8 и 9 % по массе)[9].
Этилацетат широко используется как растворитель, из-за низкой стоимости и малой токсичности, а также приемлемого запаха. В частности, как растворитель полиуретана, нитроцеллюлозы, ацетилцеллюлозы, жиров, восков, для чистки печатных плат, в смеси со спиртом — растворитель в производстве искусственной кожи. Годовое мировое производство в 1986 году составляло 450—500 тысяч тонн, в 2014 год — около 3,5 млн тонн в год.
Один из самых популярных ядов, применяемых в энтомологических морилках для умерщвления насекомых[источник не указан 754 дня]. Насекомые после умертвления в его парах гораздо мягче и податливее в препарировании, чем после умерщвления в парах хлороформа.
Обладая фруктовым запахом применяется как компонент фруктовых эссенций. Зарегистрирован в качестве пищевой добавки E1504 (ароматизатор). Добавляется в состав водок (либо образуется при реакции содержащегося в них этилового спирта с добавляемыми уксусной кислотой или уксуснокислыми солями) для смягчения запаха и вкуса спирта[10].
Лабораторное применение[править | править код]
Этилацетат часто используется для экстракции, а также для колоночной и тонкослойной хроматографии. Редко в качестве растворителя для проведения реакций из-за склонности к гидролизу и переэтерефикации.
Используется для получения ацетоуксусного эфира:[11]:
- 2Ch4COOC2H5→Ch4COCh3COOC2H5{\displaystyle {\mathsf {2CH_{3}COOC_{2}H_{5}\rightarrow CH_{3}COCH_{2}COOC_{2}H_{5}}}}
Продажный этилацетат обычно содержит воду, спирт и уксусную кислоту. Для удаления этих примесей его промывают равным объёмом 5 % карбоната натрия, сушат хлоридом кальция и перегоняют. При более высоких требованиях к содержанию воды несколько раз (порциями) добавляют фосфорный ангидрид, фильтруют и перегоняют, защищая от влаги. С помощью молекулярного сита 4А содержание воды в этилацетате можно снизить до 0,003 %.
Предельно-допустимая концентрация этилацетата в воздухе рабочей зоны составляет 50 мг/м3 (среднесменная, за 8 часов) и 200 мг/м3 (максимально-разовая)
ЛД50 для крыс составляет 11,6 г/кг, показывая низкую токсичность. Пары этилацетата раздражают слизистые оболочки глаз и дыхательных путей, при действии на кожу вызывают дерматиты и экземы. ПДК в воздухе рабочей зоны 200 мг/м³. ПДК в атмосферном воздухе населенных мест 0,1 мг/м³[14]
.Температура вспышки — 2 °C, температура самовоспламенения — 400 °C, концентрационные пределы взрыва паров в воздухе 2,1—16,8 % (по объёму).
Безопасность при транспортировке: в соответствии с ДОПОГ (ADR) класс опасности 3, код по реестру ООН 1173.
- ↑ 1 2 3 4 http://www.cdc.gov/niosh/npg/npgd0260.html
- ↑ 1 2 CRC Handbook of Chemistry and Physics / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 16–22. — ISBN 978-1-4822-0868-9
- ↑ 1 2 3 4 5 CRC Handbook of Chemistry and Physics / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 6–183. — ISBN 978-1-4822-0868-9
- ↑ 1 2 3
- ↑ 1 2 CRC Handbook of Chemistry and Physics / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 6–99. — ISBN 978-1-4822-0868-9
- ↑ CRC Handbook of Chemistry and Physics / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 15–17. — ISBN 978-1-4822-0868-9
- ↑ CRC Handbook of Chemistry and Physics / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 9–56. — ISBN 978-1-4822-0868-9
- ↑ Меньщиков В. А., Семенов И. П. Разработка процесса получения этилацетата дегидрированием этанола // Катализ в промышленности, № 5, 2012. — с. 32-36.
- ↑ Присяжнюк 3. П. Этилацетат // Этилацетат (рус.) / ред. И. Л. Кнунянц и Н. С. Зефиров. — Химическая энциклопедия. — Москва: Советская энциклопедия, 1998. — Т. 5. Триптофан — Ятрохимия. — С. 494. — 783 с. — ISBN 5-85270-310-9.
- ↑ Ильина Е. В., Макаров С. Ю., Славская И. Л. Технология и оборудование для производства водок и ликёроводочных изделий // Учебное пособие — М.: ДеЛи плюс, 2013. — 492 с. ISBN 978-5-905170-40-9 С. 24, 27, 92, 102—104, 118.
- ↑ Органикум. Том 2. Москва, Мир, 1992, с. 180.
- ↑ (Роспотребнадзор). № 2428. Этилацетат (уксусной кислоты этиловый эфир). // ГН 2.2.5.3532-18 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны» (рус.) / утверждены А.Ю. Поповой. — Москва, 2018. — С. 164. — 170 с. — (Санитарные правила).
- ↑ Janicek G., V. Pliska, and J. Kubátová. Olfactometric Estimation of the Threshold of Perception of Odorous Substances by a Flow Olfactometer (чешск.) // Československá hygiena. — Praha, 1960. — Vol. 5. — P. 441–447. — ISSN 0009-0573.
- ↑ Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест
- ГОСТ 8981-78 «Эфиры этиловый и нормальный бутиловый уксусной кислоты технические. Технические условия». (С изменениями № 1, 2, 3, 4).
Бутилацетат — Википедия
| Бутилацетат | |
|---|---|
| Общие | |
| Хим. формула | C6H12O2 |
| Физические свойства | |
| Молярная масса | 116.16 г/моль |
| Плотность | 0.8813 г/см³ |
| Энергия ионизации | 10 ± 1 эВ[1] |
| Термические свойства | |
| Т. плав. | -76,8 °C |
| Т. кип. | 126,3 °C |
| Т. всп. | 25-29 °C |
| Пр. взрв. | 1,7 ± 0,1 об.%[1] |
| Давление пара | 10 ± 1 мм рт.ст.[1] |
| Оптические свойства | |
| Показатель преломления | 1,395 |
| Классификация | |
| Рег. номер CAS | 123-86-4 |
| PubChem | 31272 |
| Рег. номер EINECS | 204-658-1 |
| SMILES | CCCCOC(C)=O |
| InChI | 1S/C6h22O2/c1-3-4-5-8-6(2)7/h4-5h3,1-2h4DKPFZGUDAPQIHT-UHFFFAOYSA-N |
| RTECS | AF7350000 |
| ChEBI | 31328 |
| ChemSpider | 29012 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Бутилацета́т — органическое вещество класса сложных эфиров, органический растворитель.
Содержание
- 1 Внешний вид
- 2 Свойства
- 3 Изомерия
- 4 Методы синтеза
- 5 Применение
- 6 Ссылки
Внешний вид
Бесцветная или слегка желтоватая жидкость с приятным фруктовым запахом.
Свойства
Бутилацетат мало растворим в воде, образует с ней азеотропную смесь. Смешивается с органическими растворителями и растительными маслами; обладает всеми свойствами сложных эфиров.
Изомерия
Бутилацетат изомерен изобутилацетату, втор-бутилацетату и трет-бутилацетату.
Методы синтеза
Бутилацетат получают этерификацией бутилового спирта уксусной кислотой.
Применение
Бутилацетат — хороший растворитель нитроцеллюлозы, хлоркаучука, глифталевых смол и др. плёнкообразующих веществ, применяемых в лакокрасочной промышленности. Входит в состав многих многокомпонентных растворителей, например в растворители 646 и 648.
Ссылки
[2]
- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0072.html
- ↑ XuMuK.ru — БУТИЛАЦЕТАТЫ — Химическая энциклопедия
| Это заготовка статьи об органическом веществе. Вы можете помочь проекту, дополнив её. |
Бутилацетат — Википедия
| Бутилацетат | |
| Общие | |
|---|---|
| Хим. формула | C6H12O2 |
| Физические свойства | |
| Молярная масса | 116.16 г/моль |
| Плотность | 0.8813 г/см³ |
| Энергия ионизации | 10 ± 1 эВ[1] |
| Термические свойства | |
| Т. плав. | -76,8 °C |
| Т. кип. | 126,3 °C |
| Т. всп. | 25-29 °C |
| Пр. взрв. | 1,7 ± 0,1 об.%[1] |
| Давление пара | 10 ± 1 мм рт.ст.[1] |
| Оптические свойства | |
| Показатель преломления | 1,395 |
| Классификация | |
| Рег. номер CAS | 123-86-4 |
| PubChem | 31272 |
| Рег. номер EINECS | 204-658-1 |
| SMILES | CCCCOC(C)=O |
| InChI | 1S/C6h22O2/c1-3-4-5-8-6(2)7/h4-5h3,1-2h4DKPFZGUDAPQIHT-UHFFFAOYSA-N |
| RTECS | AF7350000 |
| ChEBI | 31328 |
| ChemSpider | 29012 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Бутилацета́т — органическое вещество класса сложных эфиров, органический растворитель.
Содержание
- 1 Внешний вид
- 2 Свойства
- 3 Изомерия
- 4 Методы синтеза
- 5 Применение
- 6 Ссылки
Внешний вид
Бесцветная или слегка желтоватая жидкость с приятным фруктовым запахом.
Свойства
Бутилацетат мало растворим в воде; смешивается с органическими растворителями и растительными маслами; обладает всеми свойствами сложных эфиров.
Изомерия
Бутилацетат изомерен изобутилацетату, втор-бутилацетату и трет-бутилацетату.
Методы синтеза
Бутилацетат получают этерификацией бутилового спирта уксусной кислотой.
Применение
Бутилацетат — хороший растворитель нитроцеллюлозы, хлоркаучука, глифталевых смол и др. плёнкообразующих веществ, применяемых в лакокрасочной промышленности. Входит в состав многих многокомпонентных растворителей, например в растворители 646 и 648.
Ссылки
[2]
- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0072.html
- ↑ XuMuK.ru — БУТИЛАЦЕТАТЫ — Химическая энциклопедия
| Это заготовка статьи об органическом веществе. Вы можете помочь проекту, дополнив её. |
Метилацетат — Википедия
| Метилацетат | |||
|---|---|---|---|
| |||
| Систематическое наименование | метиловый эфир этановой кислоты | ||
| Сокращения | MeOAc | ||
| Традиционные названия | метиловый эфир уксусной кислоты, уксуснометиловый эфир | ||
| Хим. формула | C3H6O2 | ||
| Рац. формула | CH3COOCH3 | ||
| Состояние | жидкость | ||
| Молярная масса | 74.08 г/моль | ||
| Плотность | 0.9330 г/см³ | ||
| Динамическая вязкость | 0.362 Па·с | ||
| Энергия ионизации | 10,27 ± 0,01 эВ[1] | ||
| Удельное электрическое сопротивление | 0,52 Ом·м | ||
| Температура | |||
| • плавления | -98.1 °C | ||
| • кипения | 57.1 °C | ||
| • вспышки | -9.4 °C | ||
| • воспламенения | -10 °C | ||
| • самовоспламенения | 470 °C | ||
| Пределы взрываемости | 3,15 — 15,60 % | ||
| Критическая точка | 233.70 | ||
| Мол. теплоёмк. | 156.19 Дж/(моль·К) | ||
| Давление пара | 0,2224 атм | ||
| Растворимость | |||
| • в воде | 31,9 г/100 мл | ||
| Показатель преломления | 1.3619 | ||
| Дипольный момент | 1.72±0.09 Д | ||
| Рег. номер CAS | 79-20-9 | ||
| PubChem | 6584 | ||
| Рег. номер EINECS | 201-185-2 | ||
| SMILES | |||
| InChI | |||
| RTECS | AI9100000 | ||
| ChEBI | 77700 | ||
| Номер ООН | 1231 | ||
| ChemSpider | 6335 | ||
| Предельная концентрация | 100 мг/м³ | ||
| Токсичность | низкая | ||
| Фразы риска (R) | R11, R36, R66, R67 | ||
| Фразы безопасности (S) | S16, S26, S29, S33 | ||
| Пиктограммы СГС |   | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
Метилацета́т (метиловый эфир уксусной кислоты, метиловый эфир этановой кислоты, уксуснометиловый эфир, MeOAc) CH3COOCH3 — органическое вещество класса сложных эфиров.
Встречается в природе, большей частью в эфирных маслах растений (например, до 8,9 % в различных видах мяты[2][3], до 28,2 % в лабазнике[4], до 44 % в жасмине[5]), и в пищевых продуктах (например, в коньяках многолетней выдержки[6]).
Бесцветная прозрачная жидкость с фруктовым запахом[7].
Хорошо смешивается с органическими растворителями[7]. По растворяющей способности аналогичен ацетону и применяется в ряде случаев как его заменитель. Смешивается в любых соотношениях с этанолом и этиловым эфиром, хорошо растворим в ацетоне и хлороформе, растворим в бензоле[8].
Некоторые свойства отличаются по разным источникам: плотность 0,9330[7] и 0,9244[8][9]г/см3; показатель преломления 1,3619[7] и 1,3593[8]; динамическая вязкость 0,362[7] и 0,381[8].
Растворимость в воде 31,9 %[8], образует с водой азеотропную смесь (температура кипения 56,4 °C, 96,7 % метилацетата)[7]. Образует азеотропные смеси с метанолом (температура кипения 54 °C, 81 % метилацетата) и ацетоном (температура кипения 56,1 °C, 45 % метилацетата)[10].
Образует аддукты: метилацетат•SbCl5, метилацетат•HSbCl6 и метилацетат•BF3, плавящиеся, соответственно, при 87-88, 81-82 и 65,5 °С.
Взрывоопасные концентрации в смеси с воздухом 3,15 — 15,60 %[9].
По химическим свойствам метилацетат представляет собой типичный сложный эфир алифатической монокарбоновой кислоты.
Легко гидролизуется (омыляется) на исходные спирт и кислоту водой (обратимо) или щелочами (необратимо, так как образующаяся карбоновая кислота превращается в соль)[11][12]:
- Ch4COOCh4+h3O → Ch4COOH+Ch4OH{\displaystyle \mathrm {CH_{3}COOCH_{3}+H_{2}O\ \rightarrow \ CH_{3}COOH+CH_{3}OH} }
Восстановление метилацетата приводит к образованию двух спиртов[13] (этанол и метанол):
- Ch4COOCh4+2h3 → Ch4Ch3OH+Ch4OH{\displaystyle \mathrm {CH_{3}COOCH_{3}+2H_{2}\ \rightarrow \ CH_{3}CH_{2}OH+CH_{3}OH} }
Под действием аммиака метилацетат превращается в ацетамид и метанол[14]:
- Ch4COOCh4+Nh4 → Ch4CONh3+Ch4OH{\displaystyle \mathrm {CH_{3}COOCH_{3}+NH_{3}\ \rightarrow \ CH_{3}CONH_{2}+CH_{3}OH} }
Метилацетат получают:
- Ch4COOH+Ch4OH → Ch4COOCh4+h3O{\displaystyle \mathrm {CH_{3}COOH+CH_{3}OH\ \rightarrow \ CH_{3}COOCH_{3}+H_{2}O} }
- из уксусного ангидрида и метанола[7] (реакция протекает в жидкой фазе в отсутствии катализатора и является практически необратимой[15]):
- (Ch4CO)2O+Ch4OH → Ch4COOCh4+Ch4COOH{\displaystyle \mathrm {(CH_{3}CO)_{2}O+CH_{3}OH\ \rightarrow \ CH_{3}COOCH_{3}+CH_{3}COOH} },
- (Ch4)2CO+RC(O)OOH →H+ Ch4COOCh4{\displaystyle \mathrm {(CH_{3})_{2}CO+RC(O)OOH\ {\xrightarrow {H^{+}}}\ CH_{3}COOCH_{3}} },
Метилацетат применяют, в основном, в качестве растворителя в производстве лакокрасочных материалов и как компонент многих промышленных и бытовых растворителей. Является составной частью (7-75 %) лесохимических растворителей[16][9].
Используется при производстве клеев, композиционных лаков, шпатлевок, магнитных лент, автокосметики, эфиров целлюлозы, поливинилацетата, полиметилметакрилата, растительных и животных жиров, многих синтетических смол[16][9].
Применяется как экстрагент в аналитической химии, в том числе для отделения LiCl от хлоридов других щелочных металлов[17].
Метилацетат является ценным компонентом для промышленного синтеза, в том числе — из него карбонилированием получают уксусный ангидрид (процесс Реппеruen)[18][19]:
- Ch4CO2Ch4+CO→(Ch4CO)2O{\displaystyle {\rm {CH_{3}CO_{2}CH_{3}+CO\rightarrow (CH_{3}CO)_{2}O}}}
Используется в пищевой промышленности в качестве ароматизатора[17][20] и экстрактивного растворителя в процессе декофеинизирования чая и кофе[21]. В качестве ароматизатора и растворителя также входит в состав ряда косметических средств.
Слабо раздражает слизистые оболочки глаз и дыхательных путей (при концентрации 15 мг/л химически чистого метилацетата для ощущения раздражения требуется 5-минутная экспозиция). В высоких концентрациях оказывает лёгкое наркотическое воздействие, — в основном, за счёт действия самого сложного эфира, и, в меньшей степени, — за счёт образующегося из него спирта[9].
При пероральном введении ЛД50 = 2,9 г/кг (белые крысы), 2,4 г/кг (мыши и кролики), 3,6 г/кг (морские свинки)[9].
ПДК в атмосферном воздухе населенных мест 0,07 мг/м³[22].
По данным Роспотребнадзора, ПДК в воздухе рабочей зоны равна 100 мг/м3 (максимально-разовая)[23]. Однако по данным ряда исследований, порог восприятия запаха этого вещества может быть гораздо выше этой ПДК. Например, среднее значение порога в исследовании[24] было 900 мг/м3; в[25] 5250 мг/м3; а в[26] 8628 мг/м3. Поэтому можно ожидать, что использование широко распространённых фильтрующих СИЗОД в сочетании с «заменой фильтров по появлении запаха под маской» (как это почти всегда рекомендуется в РФ поставщиками СИЗОД) приведёт к чрезмерному воздействию паров метилацетата на, по крайней мере, часть работников — из-за несвоевременной замены противогазных фильтров. Для защиты от метилацетата следует использовать значительно более эффективные изменение технологии и средства коллективной защиты.
- ↑ http://www.cdc.gov/niosh/npg/npgd0391.html
- ↑ Мяделец М. А., Домрачев Д. В., Черемушкина В. А. Исследование химического состава эфирных масел некоторых видов семейства Lamiaceae L., стр. 113 (неопр.). Дата обращения 28 февраля 2016.
- ↑ Изучение минерального состава лекарственного растительного сырья, содержащего эфирные масла (неопр.). Дата обращения 28 февраля 2016.
- ↑ Зыкова И. Д., Ефремов А. А. Компонентный состав эфирного масла из надземной части лабазника вязолистного (неопр.). Дата обращения 28 февраля 2016.
- ↑ Горяев М. И. Эфирные масла флоры СССР, стр. 223 (неопр.). Дата обращения 28 февраля 2016.
- ↑ Урсул О. Н., Алексанян К. А., Ткачук Л. А. Сырьевые и технологические факторы выдержки коньячных спиртов (неопр.). журнал «Пищевая промышленность: наука и технологии», Минск, ISSN 2073-4794 (1 ноября 2012). Дата обращения 28 февраля 2016.
- ↑ 1 2 3 4 5 6 7 8 9 Химическая энциклопедия, том 3, 1992, с. 107.
- ↑ 1 2 3 4 5 Краткий химический справочник, 1977, с. 186.
- ↑ 1 2 3 4 5 6 7 Вредные вещества в промышленности. том 2, 1976, с. 155.
- ↑ Козлов П.В., Герц И.Б. Химия и технология полимерных плёнок, стр. 269 (неопр.). М., «Искусство» (1965). Дата обращения 28 февраля 2016.
- ↑ «Кинетика щелочного гидролиза метилацетата, бутилацетата и изобутилацетата в растворах вода-ацетонитрил» / М. Ю. Панов, О. Б. Соколова // Журнал физической химии . — 15/07/1997 . — Т. 71, N 7 . — 1199—1203
- ↑ Менделеев Д. И., Монастырский Д. Н. Эфиры сложные // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- ↑ Павлов Б.А., Терентьев А.П. Курс органической химии, стр. 256 (неопр.). М., «Химия» (1965). Дата обращения 28 февраля 2016.
- ↑ Theodore A. Koch, John G. Miller, Allan R. Day. AEffect of Structure on Reactivity. VI. Catalysis in the Ammonolysis and Hydrolysis of Methyl Acetate // Journal of the American Chemical Society (J AM CHEM SOC). — February 1953. — DOI:10.1021/ja01100a054.
- ↑ Получение метилацетата этерификацией уксусного ангидрида метанолом (неопр.). Дата обращения 28 февраля 2016.
- ↑ 1 2 Химическая энциклопедия, том 3, 1992, с. 107-108.
- ↑ 1 2 Химическая энциклопедия, том 3, 1992, с. 108.
- ↑ Ullmann, 2000, p. 244.
- ↑ Zoeller, J. R.; Agreda, V. H.; Cook, S. L.; Lafferty, N. L.; Polichnowski, S. W.; Pond, D. M. Eastman Chemical Company Acetic Anhydride Process (неопр.) // Catalysis Today. — 1992. — Т. 13. — С. 73—91. — DOI:10.1016/0920-5861(92)80188-S.
- ↑ Санитарно-эпидемиологические правила и нормативы СанПиН 2.3.2.1293-03 «Гигиенические требования по применению пищевых добавок». Приложение 6, № 861 (неопр.). Москва (15.06.2003 с изменениями от 26.05.2008). Дата обращения 28 февраля 2016.
- ↑ Курс лекций по товароведению вкусовых товаров (ЭУМК) (неопр.). БГУ. Дата обращения 28 февраля 2016. (недоступная ссылка)
- ↑ Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест (неопр.). Дата обращения 28 февраля 2016.
- ↑ (Роспотребнадзор). № 1280. Метилацетат (уксусной кислоты метиловый эфир) // ГН 2.2.5.3532-18 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны» (рус.) / утверждены А.Ю. Поповой. — Москва, 2018. — С. 91. — 170 с. — (Санитарные правила).
- ↑ Johannes May. Odor Thresholds of Solvents for Assessment of Solvent Odors in the Air [Geruchsschwellen von Losemitteln zur Bewertung von Losemittelgeruchen in der Luft] (нем.) // Staub, Reinhaltung der Luft. — Dusseldorf: VDI-Verlag GmbH, 1966. — September (vol. 26 (H. 9). — S. 385–389. — ISSN 0039-0771.
- ↑ Janicek G., V. Pliska, and J. Kubatova. Olfactometric Estimation of the Threshold of Perception of Odorous Substances by a Flow Olfactometer (чешск.) // Ceskoslovenska hygiena. — Praha, 1960. — Vol. 5. — P. 441–447. — ISSN 0009-0573.
- ↑ J. Enrique Cometto-Muniz & William S. Cain. Efficacy of Volatile Organic Compounds in Evoking Nasal Pungency and Odor (англ.) // Archives of Environmental Health: An International Journal. — Taylor & Francis, 1993. — May (vol. 48 (iss. 5). — P. 309—314. — ISSN 0003-9896. — DOI:10.1080/00039896.1993.9936719.
- Редкол.: Кнунянц И. Л. и др. Химическая энциклопедия, том 3. — М.: Советская энциклопедия, 1992. — 639 с. — ISBN 5-85270-039-8.
- Kirk-Othmer Encyclopedia, 3 td., v. 4, N.Y., 1978, p. 142—143
- Held H., Rengst A., Mayer D. Acetic Anhydride and Mixed Fatty Acid Anhydrides // Ullmann’s Encyclopedia of Industrial Chemistry. — Wiley, 2000. — DOI:10.1002/14356007.a01_065.
- Лазарев Н. В.. Вредные вещества в промышленности. том 2. — Л.: Химия, 1976. — 624 с.
- Рабинович В. А., Хавин З. Я. Краткий химический справочник. — Л.: Химия, 1977. — 376 с.
- «NIOSH Pocket Guide to Chemical Hazards. Methyl acetate» (англ.). Национальный институт охраны труда (NIOSH). Дата обращения 28 февраля 2016.
- Метилацетат. Паспорт безопасности (неопр.). Дата обращения 28 февраля 2016.
Бутилацетат — Википедия
| Бутилацетат | |
 | |
 | |
| Общие | |
|---|---|
| Хим. формула | C6H12O2 |
| Физические свойства | |
| Молярная масса | 116.16 г/моль |
| Плотность | 0.8813 г/см³ |
| Энергия ионизации | 10 ± 1 эВ[1] |
| Термические свойства | |
| Т. плав. | -76,8 °C |
| Т. кип. | 126,3 °C |
| Т. всп. | 25-29 °C |
| Пр. взрв. | 1,7 ± 0,1 об.%[1] |
| Давление пара | 10 ± 1 мм рт.ст.[1] |
| Оптические свойства | |
| Показатель преломления | 1,395 |
| Классификация | |
| Рег. номер CAS | 123-86-4 |
| PubChem | 31272 |
| Рег. номер EINECS | 204-658-1 |
| SMILES | CCCCOC(C)=O |
| InChI | 1S/C6h22O2/c1-3-4-5-8-6(2)7/h4-5h3,1-2h4DKPFZGUDAPQIHT-UHFFFAOYSA-N |
| RTECS | AF7350000 |
| ChEBI | 31328 |
| ChemSpider | 29012 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
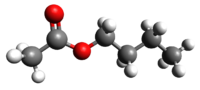
Бутилацета́т — органическое вещество класса сложных эфиров, органический растворитель.
Содержание
- 1 Внешний вид
- 2 Свойства
- 3 Изомерия
- 4 Методы синтеза
- 5 Применение
- 6 Ссылки
Внешний вид
Бесцветная или слегка желтоватая жидкость с приятным фруктовым запахом.
Видео по теме
Свойства
Бутилацетат мало растворим в воде; смешивается с органическими растворителями и растительными маслами; обладает всеми свойствами сложных эфиров.
Изомерия
Бутилацетат изомерен изобутилацетату, втор-бутилацетату и трет-бутилацетату.
Методы синтеза
Бутилацетат получают этерификацией бутилового спирта уксусной кислотой.
Применение
Бутилацетат — хороший растворитель нитроцеллюлозы, хлоркаучука, глифталевых смол и др. плёнкообразующих веществ, применяемых в лакокрасочной промышленности. Входит в состав многих многокомпонентных растворителей, например в растворители 646 и 648.
Ссылки
[2]
- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0072.html
- ↑ XuMuK.ru — БУТИЛАЦЕТАТЫ — Химическая энциклопедия
 | Это заготовка статьи об органическом веществе. Вы можете помочь проекту, дополнив её. |
Бутилацетат — Википедия. Что такое Бутилацетат
| Бутилацетат | |
 | |
 | |
| Общие | |
|---|---|
| Хим. формула | C6H12O2 |
| Физические свойства | |
| Молярная масса | 116.16 г/моль |
| Плотность | 0.8813 г/см³ |
| Энергия ионизации | 10 ± 1 эВ[1] |
| Термические свойства | |
| Т. плав. | -76,8 °C |
| Т. кип. | 126,3 °C |
| Т. всп. | 25-29 °C |
| Пр. взрв. | 1,7 ± 0,1 об.%[1] |
| Давление пара | 10 ± 1 мм рт.ст.[1] |
| Оптические свойства | |
| Показатель преломления | 1,395 |
| Классификация | |
| Рег. номер CAS | 123-86-4 |
| PubChem | 31272 |
| Рег. номер EINECS | 204-658-1 |
| SMILES | CCCCOC(C)=O |
| InChI | 1S/C6h22O2/c1-3-4-5-8-6(2)7/h4-5h3,1-2h4DKPFZGUDAPQIHT-UHFFFAOYSA-N |
| RTECS | AF7350000 |
| ChEBI | 31328 |
| ChemSpider | 29012 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Бутилацета́т — органическое вещество класса сложных эфиров, органический растворитель.
Содержание
- 1 Внешний вид
- 2 Свойства
- 3 Изомерия
- 4 Методы синтеза
- 5 Применение
- 6 Ссылки
Внешний вид
Бесцветная или слегка желтоватая жидкость с приятным фруктовым запахом.
Свойства
Бутилацетат мало растворим в воде; смешивается с органическими растворителями и растительными маслами; обладает всеми свойствами сложных эфиров.
Изомерия
Бутилацетат изомерен изобутилацетату, втор-бутилацетату и трет-бутилацетату.
Методы синтеза
Бутилацетат получают этерификацией бутилового спирта уксусной кислотой.
Применение
Бутилацетат — хороший растворитель нитроцеллюлозы, хлоркаучука, глифталевых смол и др. плёнкообразующих веществ, применяемых в лакокрасочной промышленности. Входит в состав многих многокомпонентных растворителей, например в растворители 646 и 648.
Ссылки
[2]
- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0072.html
- ↑ XuMuK.ru — БУТИЛАЦЕТАТЫ — Химическая энциклопедия
 | Это заготовка статьи об органическом веществе. Вы можете помочь проекту, дополнив её. |
Бутил — Википедия
Бутил — одновалентный радикал бутана, или заместитель с формулой −С4Н9, производное бутана или изобутана (С4Н10). Часто встречается в качестве заместителя в органических веществах.
н-Бутан может быть замещён как в оба терминальных атома, так и в два центральных.
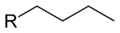
Нормальный, или н-бутил: CH3−CH2−CH2−CH2− (систематическое название: бутил)
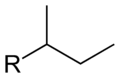
Вторичный бутил, или втор-бутил: CH3−CH2−CH(CH3)− (систематическое название: 1-метилпропил)
Другой разветвлённый изомер бутана — изобутан, может быть замещённым по трём терминальным атомам или по центральному
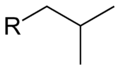
Изобутил: (CH3)2CH−CH2− (систематическое название: 2-метилпропил)
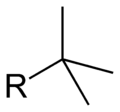
Третичный бутил, трет-бутил: (CH3)3C− (систематическое название: 1,1-диметилэтил)
Согласно номенклатуре ИЮПАК, обозначения «изобутил», «втор-бутил», и «трет-бутил» могут использоваться в качестве тривиальных.
| Структурная формула | Устоявшееся название | Номенклатура ИЮПАК | Систематическое имя | Альтернативные названия |
|---|---|---|---|---|
 | н-бутил | бутил | бутил | бутан-1-ил |
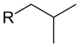 | изобутил | изобутил | 2-метилпропил | 2-метилпропан-1-ил |
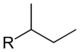 | втор-бутил | втор-бутил | 1-метилпропил | бутан-2-ил |
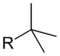 | трет-бутил | трет-бутил | 1,1-диметилэтил | 2-метилпропан-2- |
Бутил — самый большой алкильный заместитель, имеющий тривиальное название. Префикс изо-, втор- и трет- обозначают количество разветвлений цепи (также известен как RI). Изо — означает — одно, втор— два и трет-— три.
Ниже представлены варианты бутильных заместителей на примере изомеров «бутил ацетата»
С ростом количества атомов углерода радикал бутил стал последним названым исторически, а не с использованием греческого счёта. Название «бутил» происходит от английского названия масляной кислоты (англ. butyric acid), которая так названа оттого, что она содержится в прогорклом масле (англ. butter, которое, в свою очередь, восходит к лат. butyrum — масло).
С увеличивающейся разветвлённости проявляются стрерические требование бутильной группы. Трет-бутил группа создаёт стерическое напряжение вокруг себя. Это может стабилизировать вещество благодаря блокировке реакционного центра, что соответственно меняет кинетику реакции: ускорять или замедлять реакцию. В большинстве случаев происходит торможение из-за стерического отталкивания фрагентов молекулы. Ускорение происходит, когда трет-бутил фиксирует необходимую для протекания реакции конформацию.
Изобутил также как и трет-бутилгруппа способна применяться как якорная группа. Это означает, что благодаря своему стерическому эффекту изменяет предпочтения конформаций в молекуле. Так для примера отталкивание свободных алкильных групп затрудняется либо предотвращается переход из одной конформацию циклогексанового кольца в другую. Громоздкий трет-бутильный остаток остаётся предпочтительно в экваториальном положении, так как при этом уменьшается взаимодействия с другими заместителями в циклогексановом кольце. Во-вторых, возможная конформация кресла с остатком аксиальном положении, вследствие проявляется отталкивания с другими аксиальными группами. Это энергетически неблагоприятно, и равновесие смещено в сторону занятия трет-бутильной группы экваториальной конформации.
Трет-бутильный заместитель очень стерически требователен и используется в химии kinetic stabilisation вместе с другими объёмистыми группами, такими как триметилсилильная группа. Эффект, который проявляет трет-бутильная группа воздействуя на прогресс химической реакции называют трет-бутиловый эффект.
Этот эффект иллюстрируется в реакции Дильса-Альдера ниже, где трет-бутильный заместитель изменяет коэффициент скорости реакции более чем в 240 раз по сравнению с водородом как заместителя.[1]
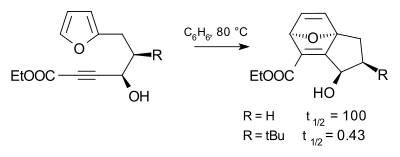
Благодаря различным позициям, которыми бутильные группы могут соединяться с остальной молекулой, он проявляет различные электроакцепторные свойства. Так между изомерами бутильного остатка электронная плотность у третичного атома углерода трет-бутилгруппы наибольшая, а у н-бутила наиболее низкая. Это отражается в повышении основных свойств литированных веществ от н-бутиллития, через втор-бутиллитий к трет-бутиллитию. Подобный эффект увеличения основности существует и в ряду 1-бутанол, 2-бутанол, трет-бутанол.
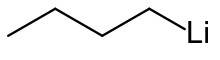 Структура н-бутиллития
Структура н-бутиллитияАлкиллитий сильное металлорганическое основание. Он может депротонировать очень слабые кислоты, ровно как и литировать вещества. Коммерчески доступны три основания бутиллития, как стандартные реактивы: н-бутиллитий, втор-бутиллитий и трет-бутиллитий.
Гидрирующий агент диизобутилалюминий гидрид содержит два изобутильных остатка.
- ↑ Factors affecting ease of ring formation. The effect of anchoring substitution on the rate of an intramolecular diels-alder reaction with furan-diene Serge Cauwberghs and Pierre J. De Clercq B. Tinant and J. P. Declercq Tetrahedron Letters Volume 29, Issue 20 , 1988, Pages 2493—2496 DOI:10.1016/S0040-4039(00)87916-2.

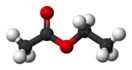 (
(
 (
(