Парафин — это… Что такое Парафин?
ПАРАФИН — (греч.). Белое жирное вещество, без вкуса и запаха, идущее на выделку свечей; добывается из торфа и смолистого сланца. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ПАРАФИН белое воскообразное тело, плавящееся… … Словарь иностранных слов русского языка
ПАРАФИН — твердый (ФУН), Paraffinum solidum, церезин, представляет собой плотную массу, состоящую из предельных и циклических углеводородов, получаемых из разных сортов нефти дальнейшей разгонкой нефтяных остатков, а также при сухой перегонке бурых углей,… … Большая медицинская энциклопедия
парафин — нефтепродукт, гексан, гептан, гомосексуалист, гач Словарь русских синонимов. парафин сущ., кол во синонимов: 14 • бельмонтин (1) • … Словарь синонимов
парафин — а, м. paraffine f., нем. Paraffin < лат. parum мало affinus сродный. Добываемое из нефти белое воскообразное легкоплавкое вещество, представляющее собой смесь углеводородов. БАС 1. Получается из нефти; применяется в пищевой промышленности. в… … Исторический словарь галлицизмов русского языка
Парафин — – смесь твердых высокомолекулярных предельных углеводородов нормального строения. [ГОСТ 26098 84] Парафин – смесь твердых высокомолекулярных предельных углеводородов нормального строения. [Терминологический словарь по бетону и… … Энциклопедия терминов, определений и пояснений строительных материалов
ПАРАФИН — ПАРАФИН, воскоподобное вещество, смесь предельных углеводородов, tпл 40 65шC. Применяют для изготовления свечей, пропитки бумаги, дерева в спичечном и карандашном производствах, для аппретирования тканей, парафинолечения и др … Современная энциклопедия
ПАРАФИН — воскоподобное вещество, смесь предельных углеводородов состава С18Н38 С35Н72. tпл 40 65 .С; плотность 0,880 0,915 г/см³ (15 .С). Получают главным образом из нефти. Применяют для приготовления парафинистой бумаги, пропитки древесины в… … Большой Энциклопедический словарь
ПАРАФИН — ПАРАФИН, белое, полупрозрачное воско образное вещество, состоящее из смеси твердых АЛКАНОВ, получаемых путем экстракции растворителями. Используется для изготовления свечей, парафинированной бумаги, средств для полировки, а также в производстве… … Научно-технический энциклопедический словарь
парафин — ПАРАФИН, парафина, мн. нет. муж. (от лат. parum affinis мало соприкасающийся) (хим., тех.). Белое воскообразное легкоплавкое вещество, представляющее собою смесь углеводородов и добываемое из нефти. Свечи из парафина. Толковый словарь Ушакова.… … Толковый словарь Ушакова
ПАРАФИН — ПАРАФИН, а, муж. Похожее на воск светлое плавкое вещество, получаемое преимущ. из нефти, используемое в промышленности и медицине. | прил. парафиновый, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ПАРАФИН — муж. природный: ископаемый воск; | деланый: перегонкой дерева, торфа, животных остатков. Парафиновые свечи не хуже спермацетовых. Толковый словарь Даля. В.И. Даль. 1863 1866 … Толковый словарь Даля
ПАРАФИН — это… Что такое ПАРАФИН?
ПАРАФИН — (греч.). Белое жирное вещество, без вкуса и запаха, идущее на выделку свечей; добывается из торфа и смолистого сланца. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ПАРАФИН белое воскообразное тело, плавящееся… … Словарь иностранных слов русского языка
ПАРАФИН — твердый (ФУН), Paraffinum solidum, церезин, представляет собой плотную массу, состоящую из предельных и циклических углеводородов, получаемых из разных сортов нефти дальнейшей разгонкой нефтяных остатков, а также при сухой перегонке бурых углей,… … Большая медицинская энциклопедия
парафин — нефтепродукт, гексан, гептан, гомосексуалист, гач Словарь русских синонимов. парафин сущ., кол во синонимов: 14 • бельмонтин (1) • … Словарь синонимов
парафин — а, м. paraffine f., нем. Paraffin < лат. parum мало affinus сродный. Добываемое из нефти белое воскообразное легкоплавкое вещество, представляющее собой смесь углеводородов. БАС 1. Получается из нефти; применяется в пищевой промышленности. в… … Исторический словарь галлицизмов русского языка
Парафин — – смесь твердых высокомолекулярных предельных углеводородов нормального строения. [ГОСТ 26098 84] Парафин – смесь твердых высокомолекулярных предельных углеводородов нормального строения. [Терминологический словарь по бетону и… … Энциклопедия терминов, определений и пояснений строительных материалов
ПАРАФИН — ПАРАФИН, воскоподобное вещество, смесь предельных углеводородов, tпл 40 65шC. Применяют для изготовления свечей, пропитки бумаги, дерева в спичечном и карандашном производствах, для аппретирования тканей, парафинолечения и др … Современная энциклопедия
ПАРАФИН — воскоподобное вещество, смесь предельных углеводородов состава С18Н38 С35Н72. tпл 40 65 .С; плотность 0,880 0,915 г/см³ (15 .С). Получают главным образом из нефти. Применяют для приготовления парафинистой бумаги, пропитки древесины в… … Большой Энциклопедический словарь
ПАРАФИН — ПАРАФИН, белое, полупрозрачное воско образное вещество, состоящее из смеси твердых АЛКАНОВ, получаемых путем экстракции растворителями. Используется для изготовления свечей, парафинированной бумаги, средств для полировки, а также в производстве… … Научно-технический энциклопедический словарь
парафин — ПАРАФИН, парафина, мн. нет. муж. (от лат. parum affinis мало соприкасающийся) (хим., тех.). Белое воскообразное легкоплавкое вещество, представляющее собою смесь углеводородов и добываемое из нефти. Свечи из парафина. Толковый словарь Ушакова.… … Толковый словарь Ушакова
ПАРАФИН — ПАРАФИН, а, муж. Похожее на воск светлое плавкое вещество, получаемое преимущ. из нефти, используемое в промышленности и медицине. | прил. парафиновый, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ПАРАФИН — муж. природный: ископаемый воск; | деланый: перегонкой дерева, торфа, животных остатков. Парафиновые свечи не хуже спермацетовых. Толковый словарь Даля. В.И. Даль. 1863 1866 … Толковый словарь Даля
парафин — это… Что такое парафин?
ПАРАФИН — (греч.). Белое жирное вещество, без вкуса и запаха, идущее на выделку свечей; добывается из торфа и смолистого сланца. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ПАРАФИН белое воскообразное тело, плавящееся… … Словарь иностранных слов русского языка
ПАРАФИН — твердый (ФУН), Paraffinum solidum, церезин, представляет собой плотную массу, состоящую из предельных и циклических углеводородов, получаемых из разных сортов нефти дальнейшей разгонкой нефтяных остатков, а также при сухой перегонке бурых углей,… … Большая медицинская энциклопедия
парафин — нефтепродукт, гексан, гептан, гомосексуалист, гач Словарь русских синонимов. парафин сущ., кол во синонимов: 14 • бельмонтин (1) • … Словарь синонимов
парафин — а, м. paraffine f., нем. Paraffin < лат. parum мало affinus сродный. Добываемое из нефти белое воскообразное легкоплавкое вещество, представляющее собой смесь углеводородов. БАС 1. Получается из нефти; применяется в пищевой промышленности. в… … Исторический словарь галлицизмов русского языка
Парафин — – смесь твердых высокомолекулярных предельных углеводородов нормального строения. [ГОСТ 26098 84] Парафин – смесь твердых высокомолекулярных предельных углеводородов нормального строения. [Терминологический словарь по бетону и… … Энциклопедия терминов, определений и пояснений строительных материалов
ПАРАФИН — ПАРАФИН, воскоподобное вещество, смесь предельных углеводородов, tпл 40 65шC. Применяют для изготовления свечей, пропитки бумаги, дерева в спичечном и карандашном производствах, для аппретирования тканей, парафинолечения и др … Современная энциклопедия
ПАРАФИН — воскоподобное вещество, смесь предельных углеводородов состава С18Н38 С35Н72. tпл 40 65 .С; плотность 0,880 0,915 г/см³ (15 .С). Получают главным образом из нефти. Применяют для приготовления парафинистой бумаги, пропитки древесины в… … Большой Энциклопедический словарь
ПАРАФИН — ПАРАФИН, белое, полупрозрачное воско образное вещество, состоящее из смеси твердых АЛКАНОВ, получаемых путем экстракции растворителями. Используется для изготовления свечей, парафинированной бумаги, средств для полировки, а также в производстве… … Научно-технический энциклопедический словарь
парафин — ПАРАФИН, парафина, мн. нет. муж. (от лат. parum affinis мало соприкасающийся) (хим., тех.). Белое воскообразное легкоплавкое вещество, представляющее собою смесь углеводородов и добываемое из нефти. Свечи из парафина. Толковый словарь Ушакова.… … Толковый словарь Ушакова
ПАРАФИН — ПАРАФИН, а, муж. Похожее на воск светлое плавкое вещество, получаемое преимущ. из нефти, используемое в промышленности и медицине. | прил. парафиновый, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ПАРАФИН — муж. природный: ископаемый воск; | деланый: перегонкой дерева, торфа, животных остатков. Парафиновые свечи не хуже спермацетовых. Толковый словарь Даля. В.И. Даль. 1863 1866 … Толковый словарь Даля
парафин — это… Что такое парафин?
ПАРАФИН — (греч.). Белое жирное вещество, без вкуса и запаха, идущее на выделку свечей; добывается из торфа и смолистого сланца. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ПАРАФИН белое воскообразное тело, плавящееся… … Словарь иностранных слов русского языка
ПАРАФИН — твердый (ФУН), Paraffinum solidum, церезин, представляет собой плотную массу, состоящую из предельных и циклических углеводородов, получаемых из разных сортов нефти дальнейшей разгонкой нефтяных остатков, а также при сухой перегонке бурых углей,… … Большая медицинская энциклопедия
парафин — нефтепродукт, гексан, гептан, гомосексуалист, гач Словарь русских синонимов. парафин сущ., кол во синонимов: 14 • бельмонтин (1) • … Словарь синонимов
парафин — а, м. paraffine f., нем. Paraffin < лат. parum мало affinus сродный. Добываемое из нефти белое воскообразное легкоплавкое вещество, представляющее собой смесь углеводородов. БАС 1. Получается из нефти; применяется в пищевой промышленности. в… … Исторический словарь галлицизмов русского языка
Парафин — – смесь твердых высокомолекулярных предельных углеводородов нормального строения. [ГОСТ 26098 84] Парафин – смесь твердых высокомолекулярных предельных углеводородов нормального строения. [Терминологический словарь по бетону и… … Энциклопедия терминов, определений и пояснений строительных материалов
ПАРАФИН — ПАРАФИН, воскоподобное вещество, смесь предельных углеводородов, tпл 40 65шC. Применяют для изготовления свечей, пропитки бумаги, дерева в спичечном и карандашном производствах, для аппретирования тканей, парафинолечения и др … Современная энциклопедия
ПАРАФИН — воскоподобное вещество, смесь предельных углеводородов состава С18Н38 С35Н72. tпл 40 65 .С; плотность 0,880 0,915 г/см³ (15 .С). Получают главным образом из нефти. Применяют для приготовления парафинистой бумаги, пропитки древесины в… … Большой Энциклопедический словарь
ПАРАФИН — ПАРАФИН, белое, полупрозрачное воско образное вещество, состоящее из смеси твердых АЛКАНОВ, получаемых путем экстракции растворителями. Используется для изготовления свечей, парафинированной бумаги, средств для полировки, а также в производстве… … Научно-технический энциклопедический словарь
парафин — ПАРАФИН, парафина, мн. нет. муж. (от лат. parum affinis мало соприкасающийся) (хим., тех.). Белое воскообразное легкоплавкое вещество, представляющее собою смесь углеводородов и добываемое из нефти. Свечи из парафина. Толковый словарь Ушакова.… … Толковый словарь Ушакова
ПАРАФИН — ПАРАФИН, а, муж. Похожее на воск светлое плавкое вещество, получаемое преимущ. из нефти, используемое в промышленности и медицине. | прил. парафиновый, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ПАРАФИН — муж. природный: ископаемый воск; | деланый: перегонкой дерева, торфа, животных остатков. Парафиновые свечи не хуже спермацетовых. Толковый словарь Даля. В.И. Даль. 1863 1866 … Толковый словарь Даля
Парафины — это… Что такое Парафины?
Эта статья — о химических соединениях. Статью о канадской алюминиевой компании Alcan см. ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2.
Алканы являются насыщенными соединениями и содержат максимально возможное число атомов водорода. Каждый атом углерода в молекулах алканов находится в состоянии sp³ гибридизации. Простейшим представителем класса является метан (CH4).
Номенклатура
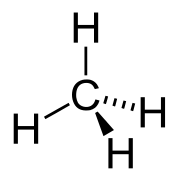
Химическая структура метана, простейшего алкана
Рациональная
Выбирается один из атомов углеродной цепи, он считается замещённым метаном и относительно него строится название алкил1алкил2алкил3алкил4метан, например:
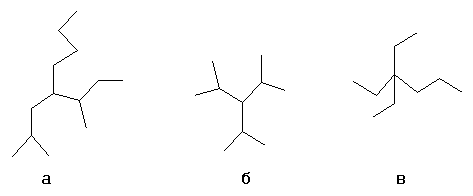
- а- н-бутил-втор-бутил-изобутилметан
- б- триизопропилметан
- в- триэтил-пропилметан
Систематическая ИЮПАК
По номенклатуре ИЮПАК названия алканов образуются при помощи суффикса -ан путём добавления к соответствующему корню от названия углеводорода. Выбирается наиболее длинная неразветвлённая углеводородная цепь так, чтобы у наибольшего числа заместителей был минимальный номер в цепи. В названии соединения цифрой указывают номер углеродного атома, при котором находится замещающий радикал, затем название радикала и название главной цепи. Если радикалы повторяются, то перечисляют цифры, указывающие их положение, а число одинаковых радикалов указывают приставками ди-, три-, тетра-. Если радикалы не одинаковые, то их названия перечисляются в алфавитном порядке. Например:
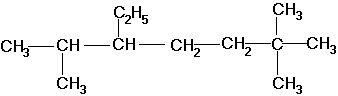
2,6,6-триметил-3-этилгептан
Гомологический ряд и изомерия
Изомерия предельных углеводородов обусловлена простейшим видом структурной изомерии — изомерией углеродного скелета. Алканы, число атомов углерода в которых больше трёх, имеют изомеры. Число этих изомеров возрастает с огромной скоростью по мере увеличения числа атомов углерода. Для алканов с n = 1..12 число изомеров равно 1, 1, 1, 2, 3, 5, 9, 18, 35, 75, 159, 355
Физические свойства
- Температура плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи
- При нормальных условиях алканы с CH4 до C4H10 — газы; с C5H12 до C17H36 — жидкости. И после C18H38 — твёрдые тела.
- Температуры плавления и кипения понижаются от менее разветвленных к более разветвленным. Так например, при нормальних условиях н-пентан жидкость, а неопентан — газ.
| Физические свойства нормальных алканов | |||||
|---|---|---|---|---|---|
| n | Название | Ткип | Тпл | Плотность | Показатель преломления |
| 1 | Метан | −164 | −182,48 | 0,466 (-452324) | — |
| 2 | Этан | −88,63 | −183,3 | 0,546 | — |
| 3 | Пропан | −42,1 | −189,7 | 0,5853 (-45) | — |
| 4 | Бутан | −0,5 | −138,35 | 0,5788 | 1,3326 |
| 4а | Изобутан | −11,73 | −159,60 | 0,5510 | 1,3508 |
| 5 | Пентан | 36,1 | −130 | 0,626 | 1,3575 |
| 6 | Гексан | 68,7 | −95 | 0,659 | 1,3749 |
| 7 | Гептан | 98,4 | −91 | 0,684 | 1,3876 |
| 8 | Октан | 125,7 | −57 | 0,703 | 1,3974 |
| 9 | Нонан | 150,8 | −54 | 0,718 | 1,4054 |
| 10 | Декан | 174,1 | −30 | 0,730 | 1,4119 |
| 11 | Ундекан | 195,9 | −25,6 | ||
| 12 | Додекан | 216,3 | −9,7 | ||
| 13 | Тридекан | 235,5 | −6,0 | ||
| 14 | Тетрадекан | 253,6 | 5,5 | ||
| 15 | Пентадекан | 270,7 | 10 | ||
| 16 | Гексадекан | 287,1 | 18,1 | ||
| 17 | Гептадекан | 302,6 | 22 | ||
| 18 | Октадекан | 317,4 | 28 | ||
| 19 | Нонадекан | 331,6 | 32 | ||
| 20 | Эйкозан | 345,1 | 36,4 | ||
| 21 | Генэйкозан | 215 (15 мм рт ст) | 40,4 | ||
| 22 | Докозан | 224,5 (15 мм рт ст) | 44,4 | ||
| 23 | Трикозан | 234 (15 мм рт ст) | 47,4 | ||
| 24 | Тетракозан | 243 (15 мм рт ст) | 51,1 | ||
| 25 | Пентакозан | 259 (15 мм рт ст) | 53,3 | ||
| 26 | Гексакозан | 262 (15 мм рт ст) | 57 | ||
| 27 | Гептакозан | 270 (15 мм рт ст) | 60 | ||
| 28 | Октакозан | 280 (15 мм рт ст) | 61,1 | ||
| 29 | Нонакозан | 286 (15 мм рт ст) | 64 | ||
| 30 | Триаконтан | 304 (15 мм рт ст) | 66 | ||
| 40 | Тетраконтан | — | 81,4 | ||
| 50 | Пентаконтан | 421 | 92,1 | ||
| 60 | Гексаконтан | — | 98,9 | ||
| 70 | Гептаконтан | — | 105,3 | ||
| 100 | Гектан | — | 115,2 | ||
Спектральные свойства
ИК-спектроскопия
В ИК-спектрах алканов четко проявляются частоты валентных колебаний связи С-Н в области 2850-3000 см-1. Частоты валентных колебаний связи С-С переменны и часто малоинтенсивны. Характеристические деформационные колебания в связи С-Н в метильной и метиленовой группах обычно лежат в интервале 1400—1470 см-1, однако метильная группа дает в спектрах слабую полосу при 1380 см-1.
УФ-спектроскопия
Чистые алканы не поглощают в ультрафиолетовой области выше 2000 Å и по этой причине часто оказываются отличными растворителями для снятия УФ-спектров других соединений.
ЯМР-спектроскопия
Масс-спектрометрия
Химические свойства
Алканы имеют низкую химическую активность. Это объясняется тем, что единичные C-H и C-C связи относительно прочны и их сложно разрушить.
Горение
Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример:
CH4 + 2O2 → CO2 + 2H2O + Q
В случае нехватки кислорода вместо углекислого газа получается угарный газ или уголь(в зависимости от нехватки кислорода)
В общем случае уравнение реакции горения для любого углеводорода CxHy, можно записать в следующем виде:
CxHy + (x + 0,25y)O2 → xCO2 + 0,5yH2O
Галогенирование
Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-светом или нагреть. Хлорирование метана не останавливается на стадии получения метилхлорида (если взяты эквимолярные количества хлора и метана), а приводит к образованию всех возможных продуктов замещения, от метилхлорида до тетрахлоруглерода. Хлорирование других алканов приводит к смеси продуктов замещения водорода у разных атомов углерода. Соотношение продуктов хлорирования зависит от температуры. Скорость хлорирования первичных, вторичных и третичных атомов зависит от температуры, при низкой температуре скорость убывает в ряду: третичный, вторичный, первичный. При повышении температуры разница между скоростями уменьшается до тех пор, пока не становится одинаковой. Кроме кинетического фактора на распределение продуктов хлорирования оказывает влияние статистический фактор: вероятность атаки хлором третичного атома углерода в 3 раза меньше, чем первичного и в два раза меньше чем вторичного. Таким образом хлорирование алканов является нестереоселективной реакцией, исключая случаи, когда возможен только один продукт монохлорирования.
Бромирование алканов отличается от хлорирования более высокой стереоселективностью из-за большей разницы в скоростях бромирования третичных, вторичных и первичных атомов углерода при низких температурах.
Иодирование алканов иодом не происходит, получение иодидов прямым иодированием осуществить нельзя.
С фтором реакция протекает со взрывом (как правило, фтор разбавляют азотом или растворителем).
Нитрование
Алканы реагируют с азотной кислотой или N2O4 в газовой фазе с образованием нитропроизводных: RH + HNO3 = RNO2 + H2O Все имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов.
Крекинг
При нагревании выше 500 °C алканы подвергаются пиролитическому разложению с образованием сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции. При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов. В 1930—1950 гг. пиролиз высших алканов использовался в промышленности для получения сложной смеси алканов и алкенов, содержащих от пяти до десяти атомов углерода. Он получил название «термический крекинг». С помощью термического крекинга удавалось увеличить количество бензиновой фракции за счёт расщепления алканов, содержащихся в керосиновой фракции (10-15 атомов С в углеродном скелете) и фракции солярового масла (12-20 атомов С). Однако октановое число бензина, полученного при термическом крекинге, не превышает 65, что не удовлетворяет требованиям условий эксплуатации современных двигателей внутреннего сгорания. В настоящее время термический крекинг полностью вытеснен в промышленности каталитическим крекингом, который проводят в газовой фазе при более низких температурах — 400—450°С и низком давлении — 10-15 атм на алюмосиликатном катализаторе, который непрерывно регенерируется сжиганием образующегося на нём кокса в токе воздуха. При каталитическом крекинге в полученном бензине резко возрастает содержание алканов с разветвлённой структурой.
Для метана: CH4→С+2H2 — при 1000 °C
Частичный крекинг: 2CH4→C2H2+3H2 (Ацетилен) — при 1500 °C
Получение
Главным источником алканов (а также других углеводородов) является нефть и природный газ, которые обычно встречаются совместно.
Восстановление спиртов
Восстановление спиртов приводит к образованию углеводородов, содержащих то же количество атомов С. Так, например, проходит реакция восстановления бутанола (C4H9OH), проходящую в присутствии LiAlH4. При этом выделяется вода.
H3C−CH2−CH2−CH2OH→H3C−CH2−CH2−CH3
Восстановление карбонильных соединений
Гидрирование непредельных углеводородов
CnH2n+H2→CnH2n+2
CnH2n-2+2H2→CnH2n+2
Синтез Кольбе
При электролизе солей карбоновых кислот, анион кислоты — RCOO— перемещается к аноду, и там, отдавая электрон превращается в неустойчивый радикал RCOO•, который сразу декарбоксилируется. Радикал R• стабилизируется путем сдваивания с подобным радикалом, и образуется R-R. Например:
2CH3COO— — 2e → 2[CH3COO•] → 2CH3• → C2H6
2C3H7COOK →{электролиз}→ C6H14
Газификация твердого топлива
Проходит при повышенной температуре и давлении. Катализатор Ni:
C+2H2→CH4
Реакция Вюрца
2R-Br + 2Na = R-R + 2NaBr
реакция идёт в ТГФ при температуре −80 °C.
при взаимодействии R и R` возможно образование смеси продуктов (R-R, R`-R`, R-R`)
Синтез Фишера-Тропша
nCO + (2n+1)H2→CnH2n+2 + H2O
Биологическое действие
Обладают наркотическим действием, которое возрастает с увеличением числа атомов углерода. При хроническом действии нарушают работу нервной системы, что проявляется в виде бессонницы, брадикардии, повышенной утомляемости и функциональных неврозов.
Литература
- Общая токсикология / под ред. А. О. Лойта. Спб.: ЭЛБИ-СПб., 2006
Ссылки
Wikimedia Foundation. 2010.
Парафины — это… Что такое Парафины?
Эта статья — о химических соединениях. Статью о канадской алюминиевой компании Alcan см. ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2.
Алканы являются насыщенными соединениями и содержат максимально возможное число атомов водорода. Каждый атом углерода в молекулах алканов находится в состоянии sp³ гибридизации. Простейшим представителем класса является метан (CH4).
Номенклатура
Химическая структура метана, простейшего алкана
Рациональная
Выбирается один из атомов углеродной цепи, он считается замещённым метаном и относительно него строится название алкил1алкил2алкил3алкил4метан, например:
- а- н-бутил-втор-бутил-изобутилметан
- б- триизопропилметан
- в- триэтил-пропилметан
Систематическая ИЮПАК
По номенклатуре ИЮПАК названия алканов образуются при помощи суффикса -ан путём добавления к соответствующему корню от названия углеводорода. Выбирается наиболее длинная неразветвлённая углеводородная цепь так, чтобы у наибольшего числа заместителей был минимальный номер в цепи. В названии соединения цифрой указывают номер углеродного атома, при котором находится замещающий радикал, затем название радикала и название главной цепи. Если радикалы повторяются, то перечисляют цифры, указывающие их положение, а число одинаковых радикалов указывают приставками ди-, три-, тетра-. Если радикалы не одинаковые, то их названия перечисляются в алфавитном порядке. Например:
2,6,6-триметил-3-этилгептан
Гомологический ряд и изомерия
Изомерия предельных углеводородов обусловлена простейшим видом структурной изомерии — изомерией углеродного скелета. Алканы, число атомов углерода в которых больше трёх, имеют изомеры. Число этих изомеров возрастает с огромной скоростью по мере увеличения числа атомов углерода. Для алканов с n = 1..12 число изомеров равно 1, 1, 1, 2, 3, 5, 9, 18, 35, 75, 159, 355
Физические свойства
- Температура плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи
- При нормальных условиях алканы с CH4 до C4H10 — газы; с C5H12 до C17H36 — жидкости. И после C18H38 — твёрдые тела.
- Температуры плавления и кипения понижаются от менее разветвленных к более разветвленным. Так например, при нормальних условиях н-пентан жидкость, а неопентан — газ.
| Физические свойства нормальных алканов | |||||
|---|---|---|---|---|---|
| n | Название | Ткип | Тпл | Плотность | Показатель преломления |
| 1 | Метан | −164 | −182,48 | 0,466 (-452324) | — |
| 2 | Этан | −88,63 | −183,3 | 0,546 | — |
| 3 | Пропан | −42,1 | −189,7 | 0,5853 (-45) | — |
| 4 | Бутан | −0,5 | −138,35 | 0,5788 | 1,3326 |
| 4а | Изобутан | −11,73 | −159,60 | 0,5510 | 1,3508 |
| 5 | Пентан | 36,1 | −130 | 0,626 | 1,3575 |
| 6 | Гексан | 68,7 | −95 | 0,659 | 1,3749 |
| 7 | Гептан | 98,4 | −91 | 0,684 | 1,3876 |
| 8 | Октан | 125,7 | −57 | 0,703 | 1,3974 |
| 9 | Нонан | 150,8 | −54 | 0,718 | 1,4054 |
| 10 | Декан | 174,1 | −30 | 0,730 | 1,4119 |
| 11 | Ундекан | 195,9 | −25,6 | ||
| 12 | Додекан | 216,3 | −9,7 | ||
| 13 | Тридекан | 235,5 | −6,0 | ||
| 14 | Тетрадекан | 253,6 | 5,5 | ||
| 15 | Пентадекан | 270,7 | 10 | ||
| 16 | Гексадекан | 287,1 | 18,1 | ||
| 17 | Гептадекан | 302,6 | 22 | ||
| 18 | Октадекан | 317,4 | 28 | ||
| 19 | Нонадекан | 331,6 | 32 | ||
| 20 | Эйкозан | 345,1 | 36,4 | ||
| 21 | Генэйкозан | 215 (15 мм рт ст) | 40,4 | ||
| 22 | Докозан | 224,5 (15 мм рт ст) | 44,4 | ||
| 23 | Трикозан | 234 (15 мм рт ст) | 47,4 | ||
| 24 | Тетракозан | 243 (15 мм рт ст) | 51,1 | ||
| 25 | Пентакозан | 259 (15 мм рт ст) | 53,3 | ||
| 26 | Гексакозан | 262 (15 мм рт ст) | 57 | ||
| 27 | Гептакозан | 270 (15 мм рт ст) | 60 | ||
| 28 | Октакозан | 280 (15 мм рт ст) | 61,1 | ||
| 29 | Нонакозан | 286 (15 мм рт ст) | 64 | ||
| 30 | Триаконтан | 304 (15 мм рт ст) | 66 | ||
| 40 | Тетраконтан | — | 81,4 | ||
| 50 | Пентаконтан | 421 | 92,1 | ||
| 60 | Гексаконтан | — | 98,9 | ||
| 70 | Гептаконтан | — | 105,3 | ||
| 100 | Гектан | — | 115,2 | ||
Спектральные свойства
ИК-спектроскопия
В ИК-спектрах алканов четко проявляются частоты валентных колебаний связи С-Н в области 2850-3000 см-1. Частоты валентных колебаний связи С-С переменны и часто малоинтенсивны. Характеристические деформационные колебания в связи С-Н в метильной и метиленовой группах обычно лежат в интервале 1400—1470 см-1, однако метильная группа дает в спектрах слабую полосу при 1380 см-1.
УФ-спектроскопия
Чистые алканы не поглощают в ультрафиолетовой области выше 2000 Å и по этой причине часто оказываются отличными растворителями для снятия УФ-спектров других соединений.
ЯМР-спектроскопия
Масс-спектрометрия
Химические свойства
Алканы имеют низкую химическую активность. Это объясняется тем, что единичные C-H и C-C связи относительно прочны и их сложно разрушить.
Горение
Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример:
CH4 + 2O2 → CO2 + 2H2O + Q
В случае нехватки кислорода вместо углекислого газа получается угарный газ или уголь(в зависимости от нехватки кислорода)
В общем случае уравнение реакции горения для любого углеводорода CxHy, можно записать в следующем виде:
CxHy + (x + 0,25y)O2 → xCO2 + 0,5yH2O
Галогенирование
Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-светом или нагреть. Хлорирование метана не останавливается на стадии получения метилхлорида (если взяты эквимолярные количества хлора и метана), а приводит к образованию всех возможных продуктов замещения, от метилхлорида до тетрахлоруглерода. Хлорирование других алканов приводит к смеси продуктов замещения водорода у разных атомов углерода. Соотношение продуктов хлорирования зависит от температуры. Скорость хлорирования первичных, вторичных и третичных атомов зависит от температуры, при низкой температуре скорость убывает в ряду: третичный, вторичный, первичный. При повышении температуры разница между скоростями уменьшается до тех пор, пока не становится одинаковой. Кроме кинетического фактора на распределение продуктов хлорирования оказывает влияние статистический фактор: вероятность атаки хлором третичного атома углерода в 3 раза меньше, чем первичного и в два раза меньше чем вторичного. Таким образом хлорирование алканов является нестереоселективной реакцией, исключая случаи, когда возможен только один продукт монохлорирования.
Бромирование алканов отличается от хлорирования более высокой стереоселективностью из-за большей разницы в скоростях бромирования третичных, вторичных и первичных атомов углерода при низких температурах.
Иодирование алканов иодом не происходит, получение иодидов прямым иодированием осуществить нельзя.
С фтором реакция протекает со взрывом (как правило, фтор разбавляют азотом или растворителем).
Нитрование
Алканы реагируют с азотной кислотой или N2O4 в газовой фазе с образованием нитропроизводных: RH + HNO3 = RNO2 + H2O Все имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов.
Крекинг
При нагревании выше 500 °C алканы подвергаются пиролитическому разложению с образованием сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции. При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов. В 1930—1950 гг. пиролиз высших алканов использовался в промышленности для получения сложной смеси алканов и алкенов, содержащих от пяти до десяти атомов углерода. Он получил название «термический крекинг». С помощью термического крекинга удавалось увеличить количество бензиновой фракции за счёт расщепления алканов, содержащихся в керосиновой фракции (10-15 атомов С в углеродном скелете) и фракции солярового масла (12-20 атомов С). Однако октановое число бензина, полученного при термическом крекинге, не превышает 65, что не удовлетворяет требованиям условий эксплуатации современных двигателей внутреннего сгорания. В настоящее время термический крекинг полностью вытеснен в промышленности каталитическим крекингом, который проводят в газовой фазе при более низких температурах — 400—450°С и низком давлении — 10-15 атм на алюмосиликатном катализаторе, который непрерывно регенерируется сжиганием образующегося на нём кокса в токе воздуха. При каталитическом крекинге в полученном бензине резко возрастает содержание алканов с разветвлённой структурой.
Для метана: CH4→С+2H2 — при 1000 °C
Частичный крекинг: 2CH4→C2H2+3H2 (Ацетилен) — при 1500 °C
Получение
Главным источником алканов (а также других углеводородов) является нефть и природный газ, которые обычно встречаются совместно.
Восстановление спиртов
Восстановление спиртов приводит к образованию углеводородов, содержащих то же количество атомов С. Так, например, проходит реакция восстановления бутанола (C4H9OH), проходящую в присутствии LiAlH4. При этом выделяется вода.
H3C−CH2−CH2−CH2OH→H3C−CH2−CH2−CH3
Восстановление карбонильных соединений
Гидрирование непредельных углеводородов
CnH2n+H2→CnH2n+2
CnH2n-2+2H2→CnH2n+2
Синтез Кольбе
При электролизе солей карбоновых кислот, анион кислоты — RCOO— перемещается к аноду, и там, отдавая электрон превращается в неустойчивый радикал RCOO•, который сразу декарбоксилируется. Радикал R• стабилизируется путем сдваивания с подобным радикалом, и образуется R-R. Например:
2CH3COO— — 2e → 2[CH3COO•] → 2CH3• → C2H6
2C3H7COOK →{электролиз}→ C6H14
Газификация твердого топлива
Проходит при повышенной температуре и давлении. Катализатор Ni:
C+2H2→CH4
Реакция Вюрца
2R-Br + 2Na = R-R + 2NaBr
реакция идёт в ТГФ при температуре −80 °C.
при взаимодействии R и R` возможно образование смеси продуктов (R-R, R`-R`, R-R`)
Синтез Фишера-Тропша
nCO + (2n+1)H2→CnH2n+2 + H2O
Биологическое действие
Обладают наркотическим действием, которое возрастает с увеличением числа атомов углерода. При хроническом действии нарушают работу нервной системы, что проявляется в виде бессонницы, брадикардии, повышенной утомляемости и функциональных неврозов.
Литература
- Общая токсикология / под ред. А. О. Лойта. Спб.: ЭЛБИ-СПб., 2006
Ссылки
Wikimedia Foundation. 2010.
Парафины — это… Что такое Парафины?
Эта статья — о химических соединениях. Статью о канадской алюминиевой компании Alcan см. ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2.
Алканы являются насыщенными соединениями и содержат максимально возможное число атомов водорода. Каждый атом углерода в молекулах алканов находится в состоянии sp³ гибридизации. Простейшим представителем класса является метан (CH4).
Номенклатура
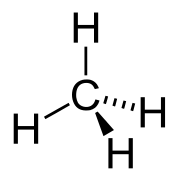
Химическая структура метана, простейшего алкана
Рациональная
Выбирается один из атомов углеродной цепи, он считается замещённым метаном и относительно него строится название алкил1алкил2алкил3алкил4метан, например:
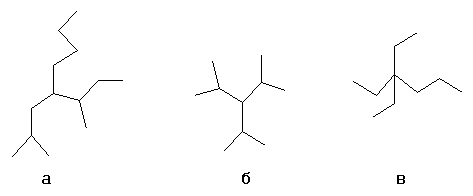
- а- н-бутил-втор-бутил-изобутилметан
- б- триизопропилметан
- в- триэтил-пропилметан
Систематическая ИЮПАК
По номенклатуре ИЮПАК названия алканов образуются при помощи суффикса -ан путём добавления к соответствующему корню от названия углеводорода. Выбирается наиболее длинная неразветвлённая углеводородная цепь так, чтобы у наибольшего числа заместителей был минимальный номер в цепи. В названии соединения цифрой указывают номер углеродного атома, при котором находится замещающий радикал, затем название радикала и название главной цепи. Если радикалы повторяются, то перечисляют цифры, указывающие их положение, а число одинаковых радикалов указывают приставками ди-, три-, тетра-. Если радикалы не одинаковые, то их названия перечисляются в алфавитном порядке. Например:
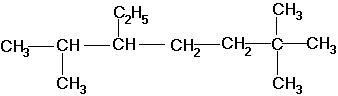
2,6,6-триметил-3-этилгептан
Гомологический ряд и изомерия
Изомерия предельных углеводородов обусловлена простейшим видом структурной изомерии — изомерией углеродного скелета. Алканы, число атомов углерода в которых больше трёх, имеют изомеры. Число этих изомеров возрастает с огромной скоростью по мере увеличения числа атомов углерода. Для алканов с n = 1..12 число изомеров равно 1, 1, 1, 2, 3, 5, 9, 18, 35, 75, 159, 355
Физические свойства
- Температура плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи
- При нормальных условиях алканы с CH4 до C4H10 — газы; с C5H12 до C17H36 — жидкости. И после C18H38 — твёрдые тела.
- Температуры плавления и кипения понижаются от менее разветвленных к более разветвленным. Так например, при нормальних условиях н-пентан жидкость, а неопентан — газ.
| Физические свойства нормальных алканов | |||||
|---|---|---|---|---|---|
| n | Название | Ткип | Тпл | Плотность | Показатель преломления |
| 1 | Метан | −164 | −182,48 | 0,466 (-452324) | — |
| 2 | Этан | −88,63 | −183,3 | 0,546 | — |
| 3 | Пропан | −42,1 | −189,7 | 0,5853 (-45) | — |
| 4 | Бутан | −0,5 | −138,35 | 0,5788 | 1,3326 |
| 4а | Изобутан | −11,73 | −159,60 | 0,5510 | 1,3508 |
| 5 | Пентан | 36,1 | −130 | 0,626 | 1,3575 |
| 6 | Гексан | 68,7 | −95 | 0,659 | 1,3749 |
| 7 | Гептан | 98,4 | −91 | 0,684 | 1,3876 |
| 8 | Октан | 125,7 | −57 | 0,703 | 1,3974 |
| 9 | Нонан | 150,8 | −54 | 0,718 | 1,4054 |
| 10 | Декан | 174,1 | −30 | 0,730 | 1,4119 |
| 11 | Ундекан | 195,9 | −25,6 | ||
| 12 | Додекан | 216,3 | −9,7 | ||
| 13 | Тридекан | 235,5 | −6,0 | ||
| 14 | Тетрадекан | 253,6 | 5,5 | ||
| 15 | Пентадекан | 270,7 | 10 | ||
| 16 | Гексадекан | 287,1 | 18,1 | ||
| 17 | Гептадекан | 302,6 | 22 | ||
| 18 | Октадекан | 317,4 | 28 | ||
| 19 | Нонадекан | 331,6 | 32 | ||
| 20 | Эйкозан | 345,1 | 36,4 | ||
| 21 | Генэйкозан | 215 (15 мм рт ст) | 40,4 | ||
| 22 | Докозан | 224,5 (15 мм рт ст) | 44,4 | ||
| 23 | Трикозан | 234 (15 мм рт ст) | 47,4 | ||
| 24 | Тетракозан | 243 (15 мм рт ст) | 51,1 | ||
| 25 | Пентакозан | 259 (15 мм рт ст) | 53,3 | ||
| 26 | Гексакозан | 262 (15 мм рт ст) | 57 | ||
| 27 | Гептакозан | 270 (15 мм рт ст) | 60 | ||
| 28 | Октакозан | 280 (15 мм рт ст) | 61,1 | ||
| 29 | Нонакозан | 286 (15 мм рт ст) | 64 | ||
| 30 | Триаконтан | 304 (15 мм рт ст) | 66 | ||
| 40 | Тетраконтан | — | 81,4 | ||
| 50 | Пентаконтан | 421 | 92,1 | ||
| 60 | Гексаконтан | — | 98,9 | ||
| 70 | Гептаконтан | — | 105,3 | ||
| 100 | Гектан | — | 115,2 | ||
Спектральные свойства
ИК-спектроскопия
В ИК-спектрах алканов четко проявляются частоты валентных колебаний связи С-Н в области 2850-3000 см-1. Частоты валентных колебаний связи С-С переменны и часто малоинтенсивны. Характеристические деформационные колебания в связи С-Н в метильной и метиленовой группах обычно лежат в интервале 1400—1470 см-1, однако метильная группа дает в спектрах слабую полосу при 1380 см-1.
УФ-спектроскопия
Чистые алканы не поглощают в ультрафиолетовой области выше 2000 Å и по этой причине часто оказываются отличными растворителями для снятия УФ-спектров других соединений.
ЯМР-спектроскопия
Масс-спектрометрия
Химические свойства
Алканы имеют низкую химическую активность. Это объясняется тем, что единичные C-H и C-C связи относительно прочны и их сложно разрушить.
Горение
Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример:
CH4 + 2O2 → CO2 + 2H2O + Q
В случае нехватки кислорода вместо углекислого газа получается угарный газ или уголь(в зависимости от нехватки кислорода)
В общем случае уравнение реакции горения для любого углеводорода CxHy, можно записать в следующем виде:
CxHy + (x + 0,25y)O2 → xCO2 + 0,5yH2O
Галогенирование
Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-светом или нагреть. Хлорирование метана не останавливается на стадии получения метилхлорида (если взяты эквимолярные количества хлора и метана), а приводит к образованию всех возможных продуктов замещения, от метилхлорида до тетрахлоруглерода. Хлорирование других алканов приводит к смеси продуктов замещения водорода у разных атомов углерода. Соотношение продуктов хлорирования зависит от температуры. Скорость хлорирования первичных, вторичных и третичных атомов зависит от температуры, при низкой температуре скорость убывает в ряду: третичный, вторичный, первичный. При повышении температуры разница между скоростями уменьшается до тех пор, пока не становится одинаковой. Кроме кинетического фактора на распределение продуктов хлорирования оказывает влияние статистический фактор: вероятность атаки хлором третичного атома углерода в 3 раза меньше, чем первичного и в два раза меньше чем вторичного. Таким образом хлорирование алканов является нестереоселективной реакцией, исключая случаи, когда возможен только один продукт монохлорирования.
Бромирование алканов отличается от хлорирования более высокой стереоселективностью из-за большей разницы в скоростях бромирования третичных, вторичных и первичных атомов углерода при низких температурах.
Иодирование алканов иодом не происходит, получение иодидов прямым иодированием осуществить нельзя.
С фтором реакция протекает со взрывом (как правило, фтор разбавляют азотом или растворителем).
Нитрование
Алканы реагируют с азотной кислотой или N2O4 в газовой фазе с образованием нитропроизводных: RH + HNO3 = RNO2 + H2O Все имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов.
Крекинг
При нагревании выше 500 °C алканы подвергаются пиролитическому разложению с образованием сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции. При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов. В 1930—1950 гг. пиролиз высших алканов использовался в промышленности для получения сложной смеси алканов и алкенов, содержащих от пяти до десяти атомов углерода. Он получил название «термический крекинг». С помощью термического крекинга удавалось увеличить количество бензиновой фракции за счёт расщепления алканов, содержащихся в керосиновой фракции (10-15 атомов С в углеродном скелете) и фракции солярового масла (12-20 атомов С). Однако октановое число бензина, полученного при термическом крекинге, не превышает 65, что не удовлетворяет требованиям условий эксплуатации современных двигателей внутреннего сгорания. В настоящее время термический крекинг полностью вытеснен в промышленности каталитическим крекингом, который проводят в газовой фазе при более низких температурах — 400—450°С и низком давлении — 10-15 атм на алюмосиликатном катализаторе, который непрерывно регенерируется сжиганием образующегося на нём кокса в токе воздуха. При каталитическом крекинге в полученном бензине резко возрастает содержание алканов с разветвлённой структурой.
Для метана: CH4→С+2H2 — при 1000 °C
Частичный крекинг: 2CH4→C2H2+3H2 (Ацетилен) — при 1500 °C
Получение
Главным источником алканов (а также других углеводородов) является нефть и природный газ, которые обычно встречаются совместно.
Восстановление спиртов
Восстановление спиртов приводит к образованию углеводородов, содержащих то же количество атомов С. Так, например, проходит реакция восстановления бутанола (C4H9OH), проходящую в присутствии LiAlH4. При этом выделяется вода.
H3C−CH2−CH2−CH2OH→H3C−CH2−CH2−CH3
Восстановление карбонильных соединений
Гидрирование непредельных углеводородов
CnH2n+H2→CnH2n+2
CnH2n-2+2H2→CnH2n+2
Синтез Кольбе
При электролизе солей карбоновых кислот, анион кислоты — RCOO— перемещается к аноду, и там, отдавая электрон превращается в неустойчивый радикал RCOO•, который сразу декарбоксилируется. Радикал R• стабилизируется путем сдваивания с подобным радикалом, и образуется R-R. Например:
2CH3COO— — 2e → 2[CH3COO•] → 2CH3• → C2H6
2C3H7COOK →{электролиз}→ C6H14
Газификация твердого топлива
Проходит при повышенной температуре и давлении. Катализатор Ni:
C+2H2→CH4
Реакция Вюрца
2R-Br + 2Na = R-R + 2NaBr
реакция идёт в ТГФ при температуре −80 °C.
при взаимодействии R и R` возможно образование смеси продуктов (R-R, R`-R`, R-R`)
Синтез Фишера-Тропша
nCO + (2n+1)H2→CnH2n+2 + H2O
Биологическое действие
Обладают наркотическим действием, которое возрастает с увеличением числа атомов углерода. При хроническом действии нарушают работу нервной системы, что проявляется в виде бессонницы, брадикардии, повышенной утомляемости и функциональных неврозов.
Литература
- Общая токсикология / под ред. А. О. Лойта. Спб.: ЭЛБИ-СПб., 2006
Ссылки
Wikimedia Foundation. 2010.
