8. Репликация днк. Ферменты репликации
Репликация ДНК — ключевое событие в ходе деления клетки. Принципиально, чтобы к моменту деления ДНК была реплицирована полностью и при этом только один раз. Это обеспечивается определёнными механизмами регуляции репликации ДНК. Репликация проходит в три этапа:
инициация репликации
элонгация
терминация репликации.
ДНК – полимераза
ДНК-полимераза — фермент, участвующий в репликации ДНК. Ферменты этого класса катализируют полимеризацию дезоксирибонуклеотидов вдоль цепочки нуклеотидов ДНК, которую фермент «читает» и использует в качестве шаблона. Тип нового нуклеотида определяется по принципу комплементарности с шаблоном, с которого ведётся считывание. Собираемая молекула комплементарна шаблонной моноспирали и идентична второму компоненту двойной спирали.
Выделяют ДНК-зависимую ДНК-полимеразу, использующую в качестве матрицы одну из цепей ДНК, и РНК-зависимую ДНК-полимеразу, способную также к считыванию информации с РНК (обратная транскрипция).
ДНК-полимеразу считают холоферментом, поскольку для нормального функционирования она требует присутствия ионов магния в качестве кофактора. В отсутствии ионов магния о ней можно говорить как об апоферментe.
ДНК-полимераза начинает репликацию ДНК, связываясь с отрезком цепи нуклеотидов. Среднее количество нуклеотидов, присоединяемое ферментов ДНК-полимеразой за один акт связывания/диссоциации с матрицей, называют процессивностью.
ДНК – лигазы
Лигаза — фермент, катализирующий соединение двух молекул с образованием новой химической связи (лигирование). При этом обычно происходит отщепление (гидролиз) небольшой химической группы от одной из молекул.
Лигазы относятся к классу ферментов EC 6.В молекулярной биологии лигазы разделяют на две большие группы — РНК-лигазы и ДНК-лигазы. ДНК-лигаза, осуществляющая репарацию ДНК
ДНК-лигазы — ферменты, катализирующие ковалентное сшивание цепей ДНК в дуплексе при репликации, репарации и рекомбинации. Они образуют фосфодиэфирные мостики между 5′-фосфорильной и 3′-гидроксильной группами соседних дезоксинуклеотидов в местах разрыва ДНК или между двумя молекулами ДНК. Для образования этих мостиков лигазы используют энергию гидролиза пирофосфорильной связи АТФ. Один из самых распространённых коммерчески доступных ферментов — ДНК-лигаза бактериофага Т4.
ДНК – геликазы
ДНК геликазы — ферменты раскручивающие двуцепочечную спираль ДНК с затратой энергии гидролиза трифосфатов NTP. Образуемая одноцепочечная ДНК участвует в различных процессах, таких как репликация, рекомбинация, и репарация. ДНК геликазы необходимы для репликации, репарации, рекомбинации и транскрипции. Геликазы присутствуют во всех организмах.
ДНК-топоизомеразы
ДНК-топоизомеразы—ферменты, изменяющие степень сверхспиральности и тип сверхспирали. Путём одноцепочечного разрыва они создают шарнир, вокруг которого нереплецированный дуплекс ДНК, находящейся перед вилкой, может свободно вращаться. Это снимает механическое напряжение, возникающее при раскручивании двух цепей в репликативной вилке, что является необходимым условием для её непрерывного движения. Кроме того, топоизомеразы (типа II) обеспечивают разделение или образование катенанов — сцепленных кольцевых ДНК (образуются в результате репликации кольцевой ДНК), а также устранение узлов и спутанных клубков из длинной линейной ДНК. Существует два типа топоизомераз. Топоизомеразы типа I уменьшают число сверхвитков в ДНК на единицу за один акт. Эти топоизомеразы надрезают одну из двух цепей, в результате чего фланкирующие дуплексные области могут повернутся вокруг интактной цепи, и затем воссоединяют концы разрезанной цепи. Эта реакция не требует энергии АТФ, т.к. энергия фосфодиэфирной связи сохраняется благодаря тому, что тирозиновый остаток в молекуле фермента выступает то в роли акцептора, то в роли донора фосфорильного конца разрезанной цепи.
Топоизомеразы типа II вносят временные разрывы в обе комплиментарные цепи, пропускают двухцепочечный сегмент той же самой или другой молекулы ДНК через разрыв, а затем соединяют разорванные концы. В результате за один акт снимаются два положительных или отрицательных сверхвитка. Топоизомеразы типа II тоже используют тирозиновые остатки для связывания 5¢-конца каждой разорванной цепи в то время . когда другой дуплекс проходит через место разрыва.
Праймаза
Праймаза—фермент, обладающий РНК-полимеразной активностью; служит для образования РНК-праймеров, необходимых для инициации синтеза ДНК в точке ori и дальнейшем для синтеза отстающей цепи.
ДНК-полимераза — Википедия
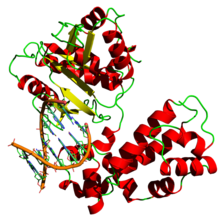 Трёхмерная структура ДНК-связывающих спирально-шпилечных участков в человеческой бета-ДНК-полимеразе (PDB: 7ICG)
Трёхмерная структура ДНК-связывающих спирально-шпилечных участков в человеческой бета-ДНК-полимеразе (PDB: 7ICG)ДНК-полимераза — фермент, участвующий в репликации ДНК. Ферменты этого класса катализируют полимеризацию дезоксирибонуклеотидов вдоль цепочки нуклеотидов ДНК, которую фермент «читает» и использует в качестве шаблона. Тип нового нуклеотида определяется по принципу комплементарности с шаблоном, с которого ведётся считывание. Собираемая молекула комплементарна шаблонной моноспирали и идентична второму компоненту двойной спирали.[1]
Выделяют ДНК-зависимую ДНК-полимеразу (КФ 2.7.7.7), использующую в качестве матрицы одну из цепей ДНК, и РНК-зависимую ДНК-полимеразу (другое название обратная транскриптаза
, КФ 2.7.7.49), способную также к считыванию информации с РНК (обратная транскрипция)[2].ДНК-полимеразу считают холоферментом, поскольку для нормального функционирования она требует присутствия ионов магния в качестве кофактора. В отсутствие ионов магния о ней можно говорить как об апоферментe.
ДНК-полимераза начинает репликацию ДНК, связываясь с отрезком цепи нуклеотидов. Среднее количество нуклеотидов, присоединяемое ферментом ДНК-полимеразой за один акт связывания/диссоциации с матрицей, называют процессивностью.

Как известно, две цепи молекулы ДНК антипараллельны. Разные концы одной цепи называются 3’-конец и 5’-конец. Репликация происходит путём непрерывного роста нуклеотида за нуклеотидом обеих новых цепей одновременно. Матрица считывается ДНК-полимеразой только в направлении 3’-5’, добавляя свободные нуклеотиды к 3’-концу собираемой цепочки. Поэтому синтез ДНК происходит непрерывно только на одной из матричных цепей, называемой «лидирующей». Во второй цепи («отстающей») синтез происходит короткими фрагментами.
Ни одна из известных ДНК-полимераз не может создать цепочку «с нуля»: они в состоянии лишь добавлять нуклеотиды к уже существующей 3’-гидроксильной группе. По этой причине ДНК-полимераза нуждается в праймере, к которому она могла бы добавить первый нуклеотид. Праймеры состоят из оснований РНК и ДНК, при этом первые два основания всегда РНК-основания. Праймеры синтезируются другим ферментом — праймазой. Ещё один фермент — хеликаза — необходим для раскручивания двойной спирали ДНК с формированием одноцепочечной структуры, которая обеспечивает репликацию обеих цепочек в соответствии с полуконсервативной моделью репликации ДНК.
Некоторые ДНК-полимеразы обладают также способностью исправлять ошибки во вновь собираемой цепочке ДНК. Если происходит обнаружение неправильной пары нуклеотидов, ДНК-полимераза откатывается на один шаг назад. Благодаря своей 3′-5′-экзонуклеазной гидролитической активности ДНК-полимераза может исключить неправильный нуклеотид из цепочки и затем вставить на его место правильный, после чего репликация продолжается в нормальном режиме.
Структура ДНК-полимераз достаточно жёстко фиксирована. Их каталитические субъединицы очень мало различаются в различных видах живых клеток. Такая фиксация структуры обычно появляется там, где отсутствие разнообразия обусловлено огромной важностью или даже незаменимостью для функционирования клетки.
Генами некоторых вирусов тоже кодируются особые ДНК-полимеразы, которые могут избирательно реплицировать вирусные ДНК. Ретровирусы обладают геном необычной ДНК-полимеразы, называемой ещё обратной транскриптазой, являющейся РНК-зависимой ДНК-полимеразой и осуществляющей сборку ДНК на основе шаблонной РНК.
На основании своей структуры ДНК-полимеразы могут быть разбиты на семь различных семейств: A, B, C, D, X, Y, и RT.
Семейство A[править | править код]
Семейство A включает в себя репликативные и восстановительные ДНК-полимеразы. Репликативные члены этого семейства представлены, например, хорошо исследованной ДНК-полимеразой вируса Т7 или эукариотической митохондриальной ДНК-полимеразой γ. Среди восстановительных полимераз мы находим такие примеры как ДНК-полимераза I E. coli, полимераза I из Thermus aquaticus или полимераза I Bacillus stearothermophilus. Восстановительные полимеразы участвуют в процессе устранения ошибок в собираемой ДНК, а также в обработке фрагментов Оказаки.
Семейство B[править | править код]
В семейство B в основном входят восстановительные полимеразы, в том числе основные эукариотические ДНК-полимеразы α, δ, и ε, а также ДНК-полимераза ζ. К этому семейству также относят ДНК-полимеразы некоторых бактерий и бактериофагов, например бактериофагов T4, Phi29 и RB69. Эти ферменты используются в синтезе и 3’-5’, и 5’-3’ моноцепей ДНК. Отличительной особенностью полимераз этого семейства является замечательная точность репликации. Многие также обладают сильным 3’-5’-экзонуклеазным действием (за исключением ДНК-полимераз α и ζ, у которых способности корректировать ошибки не наблюдается) [3].
Семейство C[править | править код]
Полимеразы этого семейства — в основном бактериальные хромосомные репликативные ферменты, обладающие, кроме того, 3’-5’-экзонуклеазным действием.
Семейство D[править | править код]
Полимеразы этого семейства недостаточно изучены. Все известные образцы считаются репликативными полимеразами и обнаружены у архей субдомена Euryarchaeota[4].
Семейство X[править | править код]
К семейству Х относится широко известная эукариотическая ДНК-полимераза β, а также и другие, такие как σ, λ, μ и концевая дезоксинуклеотидил-трансфераза (TdT). ДНК-полимераза β необходима для осуществления процесса восстановления поврежденных участков ДНК. Полимеразы λ и μ участвуют в негомологическом соединении — процессе восстановления разрывов двойной спирали.. TdT экспрессируется только в лимфоидной ткани и добавляет «n нуклеотидов» к разрывам двойной спирали, образующимся во время В(Р)С-рекомбинации. Дрожжи
Семейство Y[править | править код]
Полимеразы этого семейства отличаются от прочих низкой производительностью на целостных шаблонах, а также способностью осуществлять репликацию на шаблонах поврежденных ДНК. Вследствие этого члены семейства называются полимеразами транслезионного синтеза. В зависимости от характера повреждения (лезии) ТЛС-полимеразы могут восстановить исходную цепочку. Ошибка может и не быть восстановлена, что приводит к мутациям. Страдающие Xeroderma pigmentosum, например, обладают мутантным геном ДНК-полимеразы η (eta), который толерантен к повреждениям, однако другие полимеразы, например ζ (относящаяся к семейству B), страдают от мутаций, что, как считается, приводит к предрасположенности к онкологическим заболеваниям.
Другие члены этого семейства — человеческие полимеразы ι, κ, а также концевая дезоксинуклеотидил-трансфераза Rev1. У E.coli имеются две ТЛС-полимеразы: IV (DINB) и V (UMUC)[6].
Семейство RT[править | править код]
Семейство обратных транскриптаз (название семейства происходит от англ. reverse transcriptase) содержит полимеразы, обнаруженные как у ретровирусов, так и у эукариот. Они являются РНК-зависимыми ДНК-полимеразами, то есть, в отличие от описанных выше ферментов, используют в качестве матрицы для синтеза РНК, а не ДНК. Эукариотические обратные транскриптазы в основном представлены теломеразами. Эти полимеразы используют шаблонную РНК для синтеза цепочки ДНК.
У бактерий обнаружено пять ДНК-полимераз:
- ДНК-полимераза I задействована в восстановлении ДНК, обладает и 5′-3′, и 3′-5′-экзонуклеазным действием;
- ДНК-полимераза II участвует в репарации поврежденной ДНК. Обладает способностью 5′-3′-удлинения цепочки и 3′-5′-экзонуклеазным действием;
- ДНК-полимераза III — основная полимераза бактерий, обладающая также 3′-5′-экзонуклеазным действием;
- ДНК-полимераза IV, ДНК-полимераза семейства Y;
- ДНК-полимераза V, ДНК-полимераза семейства Y, принимающая участие в пропуске поврежденных участков ДНК.
Эукариоты содержат по меньшей мере пятнадцать видов ДНК-полимераз[7]:
- ДНК-полимераза α выступает сначала в роли праймазы, синтезируя праймер РНК, а затем как нормальная полимераза, присоединяя к этому праймеру нуклеотиды. После того, как длина цепочки достигнет около 20 нуклеотидов[8], к синтезу ДНК приступают полимеразы δ и ε;
- ДНК-полимераза β задействована в восстановлении ДНК;
- Pol γ, осуществляющая репликацию митохондриальной ДНК;
- ДНК-полимераза δ — основная полимераза эукариот. Она высокопроизводительна, а также обладает 3′-5′-экзонуклеазным действием;
- ДНК-полимераза ε, иногда замещающая ДНК-полимеразу δ во время синтеза 3’-5’-моноспирали. Основное назначение этой полимеразы неясно;
- ДНК-полимеразы η, ι, κ, и Rev1 из семейства Y, а также ζ из семейства B. Эти полимеразы задействованы в пропуске поврежденных участков ДНК[9].
- Существуют также другие эукариотические ДНК-полимеразы, которые пока недостаточно изучены: θ, λ, φ, σ и μ.
Обнаружены и другие эукариотические полимеразы.
Ни одна эукариотическая полимераза не может отщеплять праймеры, то есть не обладает 5’-3’-экзонуклеазным действием. Эту функцию выполняют другие ферменты. Только полимеразы, осуществляющие элонгацию (γ, δ и ε) обладают 3′-5′-экзонуклеазными свойствами.
- ↑ DNA polymerases : discovery, characterization, and functions in cellular DNA transactions. — Hackensack, NJ: World Scientific, 2010. — 1 online resource (xv, 321 pages) с. — ISBN 9789814299176, 9814299170.
- ↑ T. A. Steitz. DNA polymerases: structural diversity and common mechanisms // The Journal of Biological Chemistry. — 1999-06-18. — Т. 274, вып. 25. — С. 17395—17398. — ISSN 0021-9258.
- ↑ Magdalena Banach-Orlowska, Iwona J. Fijalkowska, Roel M. Schaaper, Piotr Jonczyk. DNA polymerase II as a fidelity factor in chromosomal DNA synthesis in Escherichia coli // Molecular Microbiology. — 2005-10. — Т. 58, вып. 1. — С. 61—70. — ISSN 0950-382X. — DOI:10.1111/j.1365-2958.2005.04805.x.
- ↑ Myron F. Goodman. Error-prone repair DNA polymerases in prokaryotes and eukaryotes // Annual Review of Biochemistry. — 2002. — Т. 71. — С. 17—50. — ISSN 0066-4154. — DOI:10.1146/annurev.biochem.71.083101.124707.
- ↑ Jennifer Yamtich, Joann B. Sweasy. DNA polymerase family X: function, structure, and cellular roles // Biochimica Et Biophysica Acta. — 2010-5. — Т. 1804, вып. 5. — С. 1136—1150. — ISSN 0006-3002. — DOI:10.1016/j.bbapap.2009.07.008.
- ↑ Haruo Ohmori, Tomo Hanafusa, Eiji Ohashi, Cyrus Vaziri. Separate roles of structured and unstructured regions of Y-family DNA polymerases // Advances in Protein Chemistry and Structural Biology. — 2009. — Т. 78. — С. 99—146. — ISSN 1876-1631. — DOI:10.1016/S1876-1623(08)78004-0.
- ↑ Hübscher Ulrich, Maga Giovanni, Spadari Silvio. Eukaryotic DNA Polymerases (англ.) // Annual Review of Biochemistry. — 2002. — June (vol. 71, no. 1). — P. 133—163. — ISSN 0066-4154. — DOI:10.1146/annurev.biochem.71.090501.150041. — PMID 12045093. [исправить]
- ↑ J. M. Berg; J. L. Tymoczko; L. Stryer «Biochemie», Springer, Heidelberg/Berlin 2003
- ↑ Prakash Satya, Johnson Robert E., Prakash Louise. EUKARYOTIC TRANSLESION SYNTHESIS DNA POLYMERASES: Specificity of Structure and Function (англ.) // Annual Review of Biochemistry. — 2005. — June (vol. 74, no. 1). — P. 317—353. — ISSN 0066-4154. — DOI:10.1146/annurev.biochem.74.082803.133250. — PMID 15952890. [исправить]
Праймер (молекулярная биология) | Info-Farm.RU
Праймер — короткий фрагмент нуклеиновой кислоты или связана молекула, служит исходным пунктом репликации ДНК. Праймер нужен потому, что ни одна ДНК-полимераза (фермент, который катализирует репликацию ДНК) не может начать синтез новой молекулы ДНК с одноцепочечной матрице, поскольку нужна двухцепочечная участок для присоединения к ДНК, а также они способны только присоединять нуклеотид к уже имеющейся — ОН группы на 3 ‘конце другого нуклеотида.
Репликация ДНК
В естественной репликации ДНК, в качестве праймеров используются короткие цепочки РНК длиной около 12 нуклеотидов, синтезируются ферментомпраймазою. Праймазой может присоединять как рибонулеотиды, так и дезоксирибонуклеотидов, но синтезирует именно фрагмент РНК, поскольку рибонуклеотидов в ядре больше. Эти молекулы РНК позже изымаются и заменяются на ДНК ДНК-полимеразы.
Искусственные праймеры
Многие лабораторных методов биохимии и молекулярной биологии, привлекают использования ДНК-полимеразы, например секвенирования ДНК и полимеразная цепная реакция (ПЦР), требуют праймеров. Праймеры, используемые в этих методах, обычно короткие, химически синтезированные молекулы ДНК длиной 20-30 оснований.
Для ПЦР используют 2 праймеры, которые ограничивают с двух сторон последовательность, размножается. Для повышения специфичности реакции выбирают праймеры длиной 20-30 нуклеотидов, с содержанием Г-Ц пар около 50-60%. Г-Ц пары соединены между собой тремя водородными связями, поэтому они гарантируют лучший и более выборочный связь между праймером и матрицей. Для того, чтобы последовательность праймеров была уникальная и связывалась только с одной матрицей в смеси разных молекул ДНК (например, смесь всех ДНК человека), существуют специальные программы, которые с помощью баз последовательностей ДНК подбирают нужную последовательность нуклеотидов праймера.
Для клонирования последовательностей ДНК часто в последовательности праймеров вводят дополнительные нуклеотиды — сайты рестрикции, по которым режут ферменты рестриктазы. После приумножение нужного участка ДНК в ПЦР, полученные молекулы смешивают с ферментом, который разрезает их, образуя на концах так называемые «липкие концы». Такие конце позволяют легко вставить продукт ПЦР к искусственному ДНК-вектора.
55. Репликативный комплекс (хеликаза, топоизомераза). Праймеры и их роль в репликации.
A) ДНК -раскручивающие белки:
B) Белки, препятствующие соединению нитей ДНК (SSB -белки)
C) ДНК-ПОЛИМЕРАЗА (катализирует образование фосфодиэфирных связей). ДНК- ПОЛИМЕРАЗА только удлиняет уже существующую нить, но не может соединить два свободных НУКЛЕОТИДА.
D) ПРАЙМАЗА (катализирует образование «затравки» к синтезу).
Е)ДНК-ЛИГАЗА.
5. ПРАЙМЕРЫ — «затравка» для репликации. Это короткий фрагмент, состоящий из РИБОНУКЛЕОТИДТРИФОСФАТОВ (2 — 10). Образование ПРАИМЕРОВ катализируется ПРАЙМАЗОЙ. Действуют ферменты (ТОПОИЗОМЕРАЗЫ), вызывающие раскручивание сверх спирали. SSB-белки препятствуют соединению дочерних цепей. Образуется РЕПЛИКАТИВНАЯ ВИЛКА. Образование дочерних нитей. Этому предшествует образование ПРАИМЕРОВ с помощью фермента ПРАЙМАЗЫ. Действует ДНК-ПОЛИМЕРАЗА и образуется дочерняя нить ДНК. Этот процесс происходит в соответствии с принципом комплиментарности, и синтез идёт от 5′ к 3′ концу синтезируемой нити.
Н а
одной из материнских нитей будет
строиться непрерывная цепь, а на
противоположной нити — цепь из коротких
фрагментов (фрагментов ОКАЗАКИ) Удаление
ПРАИМЕРОВ с помощью ЭКЗОНУКЛЕАЗЫ.
а
одной из материнских нитей будет
строиться непрерывная цепь, а на
противоположной нити — цепь из коротких
фрагментов (фрагментов ОКАЗАКИ) Удаление
ПРАИМЕРОВ с помощью ЭКЗОНУКЛЕАЗЫ.
44. Биосинтез рнк (транскрипция). Условия и этапы транскрипции. Процессинг рнк. Альтернативный сплайсинг
Транскрипция — передача информации с ДНК на РНК (биосинтез РНК). Транскрипции подвергаются только определённые части молекулы ДНК. Эта часть называется ТРАНСКРИПТОНОМ. ДНК эукариот прерывистая: участки, несущие информацию (ЭКЗОНЫ), чередуются с участками, не несущими информацию (ИНТРОНЫ). В ДНК с 5′-конца выделяют ПРОМОТОРНУЮ область — место присоединения РНК-ПОЛИМЕРАЗЫ. С 3′-конца — ТЕРМИНАТОРНАЯ зона. Эти области не транскрибируются. УСЛОВИЯ ТРАНСКРИПЦИИ.
1. Матрица — 1 нить ДНК. Образуется транскрипционный глазок.
2. Структурные компоненты — РИБОНУКЛЕОЗИД-3-ФОСФАТЫ (АТФ, ГТФ, ЦТФ, УТФ).
3. ДНК-зависимая РНК-ПОЛИМЕРАЗА.
ОСНОВНЫЕ ЭТАПЫ ТРАНСКРИПЦИИ.
1. ИНИЦИАЦИЯ. Заключается в присоединении РНК-ПОЛИМЕРАЗЫ к ПРОМОТОРУ, что приводит к расхождению нитей ДНК. Импульсом к присоединению РНК-ПОЛИМЕРАЗЫ является присоединение ТВР-белка к TATA-боксу.
2. ЭЛОНГАЦИЯ (удлинение). Соединение РИБОНУКЛЕОЗИДМОНОНУКЛЕОТИДОВ и образование фосфодиэфирных связей между НУКЛЕОТИДАМИ с помощью РНК-ПОЛИМЕРАЗЫ, которая передвигается вдоль нити ДНК. Присоединение НУКЛЕТИДОВ идет в соответствии с принципом комплиментарности, только будут РИБОНУКЛЕОТИДЫ и — УМФ.
3. ТЕРМИНАЦИЯ (окончание).Заключается в том, что со стороны 3′-конца образованной РНК присоединяется множество (до 200 — 300) АДЕНИЛОВЫХ НУКЛЕОТИДОВ — поли А. Образуется точная копия гена. АДЕНИЛОВЫЕ НУКЛЕОТИДЫ защищают 3′-конец от действия ЭКЗОНУКЛЕАЗ. С 5′-конца образуется защита, так называемый «САР» (чаще всего УДФ). Эта образовавшаяся копия гена называется ТРАНСКРИПТ.
4. ПРОЦЕССИНГ (созревание).
Кепирование 5-конца
Формирование полиадениловой последовательности
СПЛАЙСИНГ — удаление интронов и соединение ЭКЗОНОВ между собой. Играет важную роль в эволюции организмов,
Альтернативный СПЛАЙСИНГ- из одной пре-иРНК образуется несколько ИРНК и соответственно несколько белков, что проявляется в разнообразии признаков у организмов.
учебное пособие. Глава 4. Механизм образования и необходимость РНК-праймера (И. М. Спивак, 2011)
Многие известные теперь детали процесса репликации ДНК удалось установить благодаря исследованию поведения и активности ферментов, обеспечивающих работу аппарата репликации. Наиболее полно изучен механизм репликации бактериальной ДНК, особенно ДНК Е. соli и бактериофагов, которые в ней размножаются. Довольно хорошо известны и ферменты репликации дрожжей, Drosophila, млекопитающих.
4.3.1. ДНК-полимеразы
ДНК-подимсразы присутствуют во всех прокариотических и эукариотических клетках. Более того, многие вирусы бактерий и животных индуцируют образование вирус-специфических ДНК-полимераз или белков, способствующих эффективному участию ДНК-полимераз клеток-хозяев в репликации вирусной ДНК.
Многие прокариотические и эукариотические ДНК-полимеразы выделены в чистом виде, а их физические и ферментативные свойства детально охарактеризованы. И хотя эти свойства не совсем идентичны, механизм катализа для всех указанных ферментов в общих чертах одинаков.
Рис. 11. Общий принцип строения ДНК-полимераз.
В первичной структуре ДНК-полимераз эукариот присутствуют консервативные мотивы, гомологичные соответствующим мотивам прокариотических ферментов. Это подтверждает, что все ДНК-синтезирующие ферменты имеют общий план строения. Общий принцип строения ДНК-полимераз показан на рис. 11. По форме ДНК-полимсразы можно уподобить полураскрытой кисти правой руки, в которой ладонь, большой палец и остальные пальцы представляют три основных пространственных домена и формируют полость, удерживающую ДНК-матрицу и затравку в ходе синтеза. Консервативные мотивы А, В и С образуют активный центр в домене «ладони», «пальцы» удерживают однонитевую матрицу, а «большой палец» прижимает праймер – матричный двунитевой участок.
Применительно к различным типам ДНК-полимераз эукариот эта модель может быть модифицирована. ДНК-полимеразы работают совместно с различными белковыми комплексами, удерживающими их в вилке репликации. Чаще всего их называют «зажим» и «загрузчик зажима» («sliding clamp», «clamp loader»).
Рис. 12. Загрузка ДНК-полимеразы
После объединения ДНК-полимеразы с зажимом, «загрузчик зажима» отходит от места реакции, но держится поближе к отстающей нити, чтобы провести загрузку на новом месте объединения праймер-матрица, как только ДНК-полимераза диссоциирует при завершении синтеза предыдущего фрагмента Оказаки. Этот процесс схематически изображен на рис. 12. Подробно об этих комплексах у эукариот и их роли в репликации будет рассказано далее.
4.3.1.1. ДНК-полимеразы прокариот
Полимеразы прокариот обозначаются римскими цифрами (в отличие от полимераз эукариот, которые обозначаются греческими буквами). Наиболее полно изучена ДНК-полимераза I (Ро11) Е. соli. Она представляет собой одиночный полипептид с мультифуикциональными активностями. В качестве ДНК-полимеразы Ро11 катализирует перенос 5′-дезоксинуклеотидильных единиц дезоксинуклеозид-5′-трифосфатов к З’-ОН-группе в цепи ДНК или РНК, после чего происходит спаривание перенесенного основания с соответствующим основанием комплементарной цепи ДНК. Таким образом, для полимеризации ферменту необходимы праймер в качестве акцептора дезоксинуклеотида и матрица, определяющая присоединение нужного нуклеотида. Помимо полимеризации нуклеотидов, Ро11 катализирует две другие реакции, биологическая роль которых очень важна. В одной из них происходит гидролиз фосфодиэфирных связей в одной цепи ДНК или на неспаренном конце дуплексной ДНК, причем за один акт удаляется один нуклеотид, начиная с 3′-конца цепи (3′-5′-экзонуклеаза). Вторая реакция также состоит в отщеплении нуклеотидов, но гидролиз начинается с 5′-конца двунитевой ДНК в направлении к 3′-концу (5′-3′-экзонуклеаза). Эти различные активности присущи разным сайтам полипептидиой цепи РоlI, Если in vitro обработать РоlI трипсином, то полипептидная цепь расщепится на большой и малый фрагменты. Большой, С-концевой фрагмент («фрагмент Кленова») сохраняет ДНК-полимеразную и 3′ -5′-экзонуклеазную активности; малый N-концевой фрагмент обладает только 5′-3′-экзонуклеазной активностью.
РоlI и присущие ей экзонуклеазные активности играют очень большую роль в репликации и репарации хромосомной ДНК Е. соli. 3’-5′-экзонуклеазная активность обеспечивает контроль за присоединением каждого нуклеотида и удаление ошибочных нуклеотидов вновь синтезированной цепи. Если эта активность подавлена в результате каких-то мутаций в гене, кодирующем РоlI, то при репликации генома часто происходят мутации – замены оснований.
Способность ДНК-полимеразы удлинять 3′-конец нити, спаренной с матричной нитью, позволяет ей заполнять пробелы между сегментами отстающей нити. РоlI удлиняет фрагменты Оказаки с 3′-концов и удаляет рибонуклеотиды праймера, с которых начинаются 5′-концы соседних фрагментов, что является необходимой предпосылкой для формирования непрерывной отстающей цепи. Поскольку РоlI способна удлинять 3′-конец одной из цепей в месте разрыва в двунитевой ДНК и удалять нуклеотиды с 5′-конца того же разрыва (процесс, называемый ник-трансляцией), этот фермент играет ключевую роль в репарации поврежденной ДНК. Ник-трансляция широко используется in vitro для синтеза радиоактивно меченой ДНК.
У Е. соli имеются и две другие ДНК-полимеразы, но они присутствуют в клетке в меньших количествах. РоlII присоединяет нуклеотиды значительно менее эффективно, чем Ро11, и не обладает 5′-З’-экзонуклеазной активностью. Следовательно, РоlII может заполнять пробелы между фрагментами ДНК, спаренными с матричной цепью, но не способна отщеплять РНК-нуклеотиды от фрагментов Оказаки или осуществлять ник-трансляцию. Роль РоlII в репликации и сохранении хромосомной ДНК Е. соli до настоящего момента неясна. Вероятно, она может участвовать в восстановлении синтеза ДНК после повреждения и остановки вилки репликации. Такой процесс принято называть ресинтезом.
PolIII-холофермент – это ключевой фермент, ответственный за репликацию хромосомной ДНК Е. соli. В каждой клетке содержится только 10–20 копий PolIII – холофермента, но именно он является основным компонентом мультиферментного полимеразного комплекса, инициирующего формирование репликативных вилок в точках начала репликации, участвующего в элонгации лидирующей цепи в вилке и удлиняющего РНК-праймеры с образованием фрагментов Оказаки. Так как PolIII – холофермент не обладает 5′-3′-экзонуклеазной активностью, для репликации отстающей цепи необходимо участие РоlI, чтобы произошло удлинение продукта, образовавшегося при участии PolIII, и удаление РНК-праймеров на 5′-конце фрагментов Оказаки.
Методом направленного мутационного анализа обнаружены изменения в полипептидной цепи основного (кор) фермента PolIII, и изучены аминокислотные замены, которые позволяют приписать определенные виды ферментативной активности конкретным субъединицам ферментного комплекса. Так, α-субъединица обладает полимеразной активностью, а ε-субъединица – 3′ 5′-экзонуклеазной. Однако комплекс α– и ε-субъединиц обладает значительно более высокой полимеразной и экзонуклеазной активностями, чем каждая из соответствующих субъединиц в отдельности. Функция третьей, θ-субъединицы пока неясна.
Помимо субъединиц, составляющих PolIII – кор, PolIII-холофермент содержит еще семь субъединиц: τ,γ,β,δ,δ’,χ, и ψ. Перечисленные полипепгиды также существуют во множестве копий, так что в результате мол. масса полимеразного комплекса составляет примерно 103 кДа. Роль β-субъединицы заключается в том, чтобы свести к минимуму вероятность отделения фермента от матрицы до завершения процесса копирования, то есть работает как «зажим». Субъединица τ является фактором димеризации репликативных холоферментов. Точная же функция других субъединиц неизвестна. Вполне возможно, что PolIII-холофермент существует в двух формах, каждая из которых содержит определенный набор вспомогательных субъединиц, придающих ферменту определенные свойства. В одной форме фермент катализирует синтез непрерывной ведущей цепи, а в другой – прерывистой отстающей.
PolIII-холофермент катализирует же реакции синтеза, что и PolI, но работает примерно в 60 раз быстрее. Более того, PolIII-холофермент обладает повышенным сродством к матрице и обеспечивает более высокую эффективность копирования. PolIII-холофермент может связываться и с другими белками, увеличивая эффективность процесса копирования благодаря координации некоторых важных ферментативных этапов репликации. На этом более высоком уровне организации в комплексы могут включаться белки, расплетающие спираль ДНК в точках начала репликации и в репликативных вилках (геликазы), инициирующие образование праймерных РНК (праймазы), обеспечивающие последовательное наращивание цепей ДНК, терминирующие процесс репликации и разделяющие дочерние спирали ДНК.
ДНК-полимеразы, синтезируемые другими бактериями и многими бактериофагами, различаются по своим физической структуре и свойствам. Тем не менее, катализируемые ими реакции практически идентичны реакциям, изученным у Е. соli. У всех ДНК-полимераз есть корректирующая 3′-5′-экзонуклеаза, однако 5′-3′-экзонуклеаза у большинства ферментов отсутствует. Например, ДНК-полимераза фага Т4 может осуществлять 3′-5′-экзонуклеазную реакцию и корректировать ошибки репликации, но не способна катализировать 5’– З’-экзонуклеазную реакцию и поэтому не может обеспечить ник-трансляцию. При репликации ДНК фага Т4 5′-3′-экзонуклеазную реакцию удаления РНК-праймеров перед объединением фрагментов Оказаки катализирует другой кодируемый фагом белок. В процессе прерывистого синтеза отстающих нитей и репарации повреждений ДНК фага Т4 этот фермент работает согласованно с фаговой ДНК-полимеразой. Некоторые вирусы животных (например, герпесвирус, вирус коровьей оспы и вирус гепатита) индуцируют синтез особых полимераз для репликации своих геномов.
Другие вирусы образуют белки, которые стимулируют системы репликации клеточной ДНК или участвуют в репликации вирусной ДНК. Например, паповавирусы синтезируют белки, необходимые для инициации репликации. Аденовирусы человека кодируют белки, «запускающие» инициацию синтеза обеих цепей линейной вирусной ДНК. Они продуцируют также особые ДНК-связывающие белки, облегчающие репликацию.
4.3.1.2. ДНК-полимеразы эукариот
В эукариотических клетках идентифицировано множество ДНК-полимераз, но их физические и функциональные свойства изучены менее детально, чем у соответствующих ферментов прокариот.
Таблица 3
ДНК-полимеразы эукариот
Точная пространственная структура, определенная с помощью рентгеноструктурного анализа, известна лишь для одной ДНК-полимеразы эукариот – полимеразы β-типа, которая заметно отличается по строению от других эукариотических ДНК-полимераз. Сводные данные об основных полимеразах эукариот приведены в таблице 3.
4.3.1.3. ДНК-полимераза α – праймаза
В клетках эукариот синтез ДНК происходит, в основном, в специфических плотных структурах («репликативных фабриках»), присоединенных к диффузному ядерному матриксу. Предполагается, что в молекулярной организации ядерного матрикса играют некоторую роль фосфолипиды и что ДНК связана с ядерным скелетом гидрофобными взаимодействиями. «Репликативные фабрики» или 21S репликативные комплексы, включают в себя группу ферментов, состоящую не менее чем из 30 белков с молекулярной массой от 15 до 300 кДа, и содержат помимо ДНК-полимеразы α – праймазы еще и 3′-5′-экзонуклеазу, ДНК-лигазу I, РНКазу Н, ДНК-топоизомеразу I, ДНК-геликазу, РСNA и ряд других факторов. Также этот комплекс содержит RРА, специфически взаимодействующий с субъединицей р48 комплекса полимераза-праймаза. Значительный запас ДНК-полимеразы α накапливается в яйцеклетках иглокожих, амфибий, костистых рыб и дрозофилы для обеспечения интенсивной репликации ядерной ДНК в ходе раннего развития.
Как правило, ДНК-полимеразы α не обладают корректорской 3’—5′-экзонуклеазной активностью. Однако в каталитической субъединице 182 кДа ДНК-полимеразы α дрозофилы обнаружена 3’—5′-экзонуклеаза, проявляющая активность только при диссоциации субъединицы 73 кДа.
Мультибелковая форма ДНК-полимеразы α содержит также белок, который связывает динуклеотид диаденозинтетрафосфат (Ар4А). Предполагается, что Ар4А участвует в репликации ДНК и клеточном делении. Имеются данные о способности ДНК-полимеразы α использовать Ар4А в качестве праймера. Однако участие Ар4А в качестве праймера in vivo маловероятно, скорее он используется как эффектор. Интересно, что триптофанил-тРНК-синтетаза, синтезирующая этот динуклеотид, находится в том же мултибелковом комплексе.
Обычно комплекс праймаза-полимераза α состоит из четырех субъединиц: большой субъединицы с молекулярной массой 180 кДа, или семейства полипептидов с размерами от 140 до 160 кДа; субъединицы с молекулярной массой около 68–70 кДа и двух малых субъединиц с молекулярными массами 54–58 и 46–50 кДа. Субъединица р180 отвечает за полимеразную функцию. С двумя малыми субъединицами связана праймазная активность. При этом субъединица 48 кДа является каталитической и непосредственно осуществляет праймирование ДНК, а субъединица 58 кДа участвует в связывании инициирующего пуринового нуклеотида и присоединении субъединицы р48 к ДНК-полимеразе α. Она также влияет на скорость полимеризации и стабильность продукта, синтезируемого субъединицей 48 кДа. р58 также облегчает проникновение р48 из цитоплазмы в ядро. Субъединица р180 непосредственно взаимодействует с р58.
С каталитической субъединицей связана субъединица 68–70 кДа, которая необходима для транспорта каталитического полипептида в клеточное ядро. Субъединица 68–70 кДа участвует также в регуляции уровня ДНК-полимеразы α в клетке, она стимулирует синтез каталитического полипептида. Хотя комплекс ДНК-полимераза α-праймаза состоит из четырех субъединиц, количественный состав этого комплекса может быть различным. Вероятно, полимераза α и праймаза находятся в «коре» в соотношении 1: 3.
4.3.1.4. Реакция праймирования
Инициация репликации и прерывистый синтез ДНК на отстающей цепи происходит по РНК-праймерному механизму и является универсальным свойством репликации ДНК у про– и эукариот.
ДНК-праймаза отличается от других РНК-полимераз целым рядом присущих только ей свойств. Во-первых, матричной и субстратной специфичностью. Во-вторых, необычной процессивностью – синтезом мультимеров, кратных 10-нуклеотидным звеньям. В-третьих, низкой точностью и устойчивостью к некоторым ингибиторам РНК– и ДНК-полимераз. Здесь необходимо вернуться к проблеме синтеза РНК-праймеров. Синтез РНК-праймеров на природных матрицах начинается во множественных, но не случайных участках, его инициация происходит с АТР или GТР даже при высоких концентрациях СТР и UTР. Показано, что, например, ДНК вируса SV40 содержат предпочтительные участки инициации – 3′-dСТТТ или 3′-dССС, расположенные внутри участков из 7-25 пиримидиновых нуклеотидов. Высокое соотношение АТР/GТР повышает вероятность инициации в участках 3′-dСТТТ, а низкое – в участках 3′-dССС. Таким образом, концентрация NТР и нуклеотидная последовательность матрицы определяют участки инициации. Впрочем, участки инициации in vivo заметно отличаются от участков инициации, используемых во время репликации ДНК SV40. Во многих случаях обнаружена последовательность 5′-YYYYYYYYСТТТYYYY-3′, где Y = С или Т, которая является стартовой площадкой для инициации синтеза ДНК-праймазой в составе комплекса с ДНК-полимеразой α. Минимальная длина пиримидинового кластера должна быть не менее 7 н. Замена одного из пиримидинов на 3′-конце кластера значительно понижает частоту инициации, а замены внутри и вне кластера приводят к смещению точки старта. Известно, что матрицу распознает сама ДНК-праймаза. Стартовый нуклеотид вновь синтезированного праймера всегда является пурином (чаще всего – аденином).
Этот комплекс имеет еще одну специфическую функцию – синтез теломерной отстающей цепи ДНК млекопитающих осуществляет ДНК-полимераза α-праймаза.
ДНК-праймаза – сравнительно медленный фермент. Средняя скорость включения NTP этим ферментом примерно на два порядка меньше, чем скорость включения dNТР ДНК-полимеразой α. ДНК-полимераза α способна удлинять праймеры длиной более 7-10 н. Продукты длиной 2–6 н. не являются субстратами ДНК-полимеразы α и называются абортивными, До синтеза РНК-праймера ДНК-полимераза α и ДНК-праймаза действуют независимо, а после этого их активности координируются. Синтезированный РНК-праймер перемещается в полимеразный активный центр без диссоциации в раствор. Это внутримолекулярное перемещение праймера в дуплексе с матрицей является быстрым и сравнимо по скорости с синтезом праймера. После того как ДНК-полимераза α удлинит праймер, праймаза начинает синтез нового праймера, и цикл повторяется. ДНК-праймаза эукариот отличается от других РНК-полимераз своей способностью к включению дезоксирибонуклеотида в праймер, таким же свойством обладает и праймаза прокариот. Одним из возможных объяснений необходимости включения dNТР в 3′-конец праймера является необходимость перехода от А-формы к В-форме ДНК. Поэтому понимание механизма «переключения» комплекса ДНК-полимеразы α-праймазы от синтеза РНК к ДНК имеет очень большое значение. Способность праймазы узнавать одновременно и рибо-, и дезоксириботрифосфаты представляет серьезный научный интерес.
Выбор РНК-праймера определяется гидрофобным характером белково-нуклеиновых взаимодействий. В случае гибрида РНК-ДНК дуплекс находится в А-форме, в которой обеспечивается оптимальный баланс между гидрофобными и комплементарными взаимодействиями оснований матрицы и праймера.
После инициации рост праймера сопровождается извлечением оснований матрицы из гидрофобной полости белка для спаривания с основаниями растущей цепи РНК. В условиях такой конкуренции короткие ди– и тринуклеотиды легко диссоциируют, образуя абортивные продукты. С ростом длины праймера прочность дуплекса увеличивается, ослабевает влияние гидрофобности активного центра, и пары оснований приближаются к оси спирали. При длине праймера 7 н создаются условия для включения дезоксинуклеотида и перехода в энергетически более выгодную В-форму. Здесь нужно учитывать и большее сродство к ферменту dNТР по сравнению с NТР. Предложенная концепция, по-видимому, носит универсальный характер, поскольку подобное происходит и при инициации транскрипции.
ДНК-полимераза α связывает сначала матрицу, затем праймер и субстрат. ДНК-полимераза α наиболее активна на двунитевой ДНК, содержащей бреши длиной не менее 20–30 н. Область связывания матрицы с ДНК-полимеразой α является достаточно протяженной. Она строго защищает от гидролиза 9 н праймерной цепи, 13 н двухцепочечного участка и 14 н одноцепочечной матрицы и слабо защищает несколько оснований вне этого района. Фермент связывается с 19–20 н матрицы посредством ионных и гидрофобных взаимодействий, эффективность связывания при этом коррелирует с гидрофобностью оснований матрицы.
Отличительной особенностью ДНК-полимеразы α является ее способность удлинять РНК-праймеры и прочная ассоциация с ДНК-праймазой, которая синтезирует эти праймеры.
Средняя процессивность ДНК-полимеразы α составляет 20–50 н. Праймаза редко ошибается в момент синтеза динуклеотида, но затем легко использует неправильные NТР. Хотя скорость включения ошибочных нуклеотидов зависит от нуклеотидной последовательности матрицы и самого неправильного нуклеотида, в принципе, ДНК-праймаза является самым неточным нуклеотид-полимеризующим ферментом. В некоторых случаях один неправильный нуклеотид приходится менее чем на 100 правильных. Встраивание неправильного нуклеотида не препятствует включению следующего правильного нуклеотида. Праймаза может полимеризовать сходные нуклеотиды и генерировать праймеры с множественными ошибками, котрые не ингибируют дальнейший синтез и после внутримолекулярного переноса в ДНК-полимеразный активный центр удлиняются ДНК-полимеразой в присутствии dNTP.
Существуют две модели механизма синтеза праймеров, некомплементарных матрице. Согласно первой модели, фермент просто включает некомплементарные матрице нуклеотиды. Вторая модель предполагает включение нуклеотида, комплементарного матрице, с последующим скольжением праймера относительно матрицы. Низкая точность ДНК-праймазы послужила основой гипотезы о том, почему именно РНК является затравкой при репликации ДНК. Поскольку первые нуклеотиды могут ошибочно включаться в новую растущую цепь, предполагается, что РНК-праймер отмечает «высокоошибочный» участок для последующего вырезания и более точной застройки. Эта точка зрения выглядит убедительной, но, вероятно, главная причина появления РНК-праймера связана все-таки с более эффективной инициацией синтеза ДНК при наличии А-формы РНК-ДНК дуплекса.
Конец ознакомительного фрагмента.
праймаза — это… Что такое праймаза?
Праймаза — ДНК праймаза это фермент РНК полимераза, который принимает участие в репликации ДНК. Праймаза синтезирует короткий фрагмент РНК, называемый праймером, комплементарный одноцепочечной матрице ДНК. Праймаза играет ключевую роль в репликации… … Википедия
ДНК-праймаза — * ДНК праймаза * DNA primase фермент, осуществляющий синтез РНК праймера (), необходимого для синтеза фрагментов Оказаки, а также РНК праймеров в процессе синтеза репликативной формы ДНК бактериофагов. У E. coli ДНК п. кодируется геном dna C (М.… … Генетика. Энциклопедический словарь
ДНК-праймаза — DNA primase ДНК праймаза. Фермент, осуществляющий синтез РНК затравки для последующего синтеза фрагментов Оказаки <Okazaki fragments>, а также синтез РНК затравок в процессе синтеза репликативной формы <replication form> ДНК… … Молекулярная биология и генетика. Толковый словарь.
ДНК-праймаза — Фермент, осуществляющий синтез РНК затравки для последующего синтеза фрагментов Оказаки, а также синтез РНК затравок в процессе синтеза репликативной формы ДНК бактериофагов; у E.coli кодируется геном dnaG, ее молекулярная масса составляет 60 кД; … Справочник технического переводчика
Праймосома — * праймасома * primosome комплекс белков (ферментов), в т. ч. праймаза (см.), требующийся для праймирующего действия, т. е. для инициации (затравки) синтеза запаздывающей цепи (см.) в репликативной вилке (см.) посредством образования фрагментов… … Генетика. Энциклопедический словарь
Репликация (биология) — Схематическое изображение процесса репликации, цифрами отмечены: (1) запаздывающая нить, (2) лидирующая нить, (3) ДНК полимераза (Polα), (4) ДНК лигаза, (5) РНК праймер, (6) ДНК праймаза, (7) фрагмент Оказаки, (8) ДНК полимераза (Polδ), (9)… … Википедия
DnaG — DnaG это праймаза, которая синтезирует праймер рибонуклеиновой природы. Основная функция фермента DnaG синтез праймеров фрагментов Оказаки у E. coli.[1] Для осуществления праймазной активности DnaG связывается с DnaB. Примечания ↑… … Википедия
Репликация ДНК — У этого термина существуют и другие значения, см. Репликация. Схематическое изображение процесса репликации, цифрами отмечены: (1) запаздыв … Википедия
Пререпликационный комплекс — (англ. pre replication complex, pre RC) это комплекс белков, который образуется на стадии инициации репликации ДНК. Белки, которые принимают участие в пререпликационном комплексе, строго необходимы для репликации.[1] Пререпликационный… … Википедия
Репликация (цитология) — Схематическое изображение процесса репликации, цифрами отмечены: (1) запаздывающая нить, (2) лидирующая нить, (3) ДНК полимераза (Polα), (4) ДНК лигаза, (5) РНК праймер, (6) ДНК праймаза, (7) фрагмент Оказаки, (8) ДНК полимераза (Polδ), (9)… … Википедия
РЕПЛИКАЦИЯ — (от позднелат. replicatio повторение) (редупликация), самовоспроизведение нуклеиновых к т (обычно ДНК, у нек рых вирусов РНК), обеспечивающее точное копирование генетич. информации и передачу ее от поколения к поколению. При Р. ДНК нуклеотидная… … Химическая энциклопедия
фрагменты Оказаки — Okazaki fragments
 репликация ДНК
репликация ДНКФрагменты Оказаки представляют собой короткие последовательности ДНК нуклеотидов (приблизительно от 150 до 200 пар оснований долго в эукариотах ), синтезируемых прерывисто , а затем связаны друг с другом с помощью фермента ДНК — лигазы , чтобы создать отстающую нить во время репликации ДНК . Они были обнаружены в 1960 — х годах японские молекулярные биологи Reiji и Тсунко Оказаки , а также с помощью некоторых из своих коллег.
Во время репликации ДНК, то двойная спираль раскручивается и комплементарные нити разделяются с помощью фермента геликазы ДНК , создавая то , что известно как ДНК репликативной вилки . После этой вилки, ДНК праймаза , а затем ДНК — полимераза , начинает действовать для того , чтобы создать новую комплементарную цепь. Поскольку эти ферменты могут работать только в 5′ к 3′ , две расплетенные нити шаблона реплицируются различными способами. Одна нити, то ведущая нить , проходит непрерывный процесс репликации , поскольку его шаблон жила имеет 3′ 5′ направленность, что позволяет полимеразу сборке ведущей нити следовать вилке репликации без перерыва. Отставание прядь, однако, не может быть создана в непрерывном режиме , так как его шаблон прядь имеет 5′ к 3′ , что направленность означает полимераза должна работать в обратном направлении от репликативной вилки. Это вызывает периодические перерывы в процессе создания отстающей нити. Праймаз и полимеразное движение в противоположном направлении вилки, так что ферменты должны многократно прекратить и начать заново в то время как геликаз ДНК разрушает нить друг от друга. После того, как фрагменты сделаны, ДНК — лигаза соединяет их в единую, непрерывную цепь. Процесс репликации все считается «полу-прерывистым» , так как один из новых нитей непрерывно формируется и другой нет.
В течение 1960 — х годов, Reiji и Тсунко Оказаки провели эксперименты с участием репликации ДНК в бактерии кишечной палочки . До этого времени было принято считать , что репликация представляет собой непрерывный процесс для обеих нитей, но открытия с участием кишечной палочки привело к новой модели репликации. Ученые обнаружили , был прерывистый процесс репликации ДНК-импульсной маркировки и наблюдение изменений , которые указывали на несмежных репликацию.
Эксперименты
Синтез фрагментов OkazakiРабота Kiwako Sakabe и Reiji Оказаки при условии , экспериментальных данных , подтверждающих гипотезу о том, что репликация ДНК является прерывистым процессом. Ранее было принято считать , что репликация была сплошной и в 3′ к 5′ и 5′ к 3′ направлений. 3′ и 5′ специально пронумерован атом углерода на кольце дезоксирибозы в нуклеиновых кислотах, и относятся к ориентации или направленности на нить. В 1967 году Okazakis и их коллеги предположили , что не существует найден механизм , который показал непрерывную репликацию в 3′ — 5′ направлении, только от 5′ к 3′ с помощью ДНК — полимеразы , фермент репликации. Команда предположила , что , если была использована разрывная репликации, короткие нити ДНК , синтезированные в точке реплицирующейся, может быть присоединены в 5′ к 3′ направления к старой цепи.
Чтобы отличить метод репликации ДНК , используемой в эксперименте, команда импульсно-меченная вновь реплицируются области кишечной палочки хромосом, денатурированных, и экстрагировали ДНК. Большое количество радиоактивных коротких блоков означает , что метод репликации, вероятно , прерывистый. Гипотеза была дополнительно подтверждается открытием полинуклеотидной лигазы , фермент , который связывает короткие нити ДНК вместе.
В 1968 году Реджи и Тсунко Оказаки собрали дополнительные доказательства формирующихся нитей ДНК. Они предположили , что если разрывная репликации, включая короткие цепи ДНК , связанные вместе полинуклеотидной лигазой, является механизмом , используемым в синтезе ДНК, затем «вновь синтезированные короткие цепи ДНК будет накапливаться в клетке в условиях , когда функция лигазы временно нарушена.» E.coli , были заражены бактериофага Т4 , которые производят термочувствительным полинуклеотидной лигазы. Клетки , инфицированные фагами Т4 накопилось большое количество коротких, вновь синтезированных цепей ДНК, как было предсказано в гипотезе, при воздействии высоких температур. Этот эксперимент дополнительно поддерживает гипотезу Okazakis’ прерывистой репликации и связывания с полинуклеотидной лигазой. Он опроверг мнение , что короткие цепочки были произведены во время процесса экстракции , а также.
Эксперименты Okazakis’ представили обширную информацию о процессе репликации ДНК и наличие коротких, вновь синтезированных цепей ДНК, которые позже стали известны как Okazaki фрагменты.
Процесс
Подготовка
Два пути были предложены для обработки Оказаков фрагментов: короткий путь закрылков и длинный лоскут пути.
Короткий лоскут Тропинка
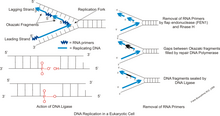
В коротком закрылка пути в эукариот отстающий цепь ДНК заливают в короткие промежутки времени. В только коротком пути, ядро FEN1 участвуют. Pol δ часто встречается вниз по течению загрунтованного фрагмента Okazaki и смещает РНК / ДНК инициатора праймера в 5 ‘лоскута. В FEN1 5′-3′ — эндонуклеазой признает , что 5′ лоскут перемещается, и он расщепляет, создавая субстрат для лигирования. В этом методе Поль а-синтезирован праймер удаляется. Исследования показывают , что в FEN1 предлагают «отслеживание; модель , в которой нуклеаза перемещается из лоскута от 5′ до его основания преформы расщепления. Pol δ не обрабатывает активность ядра расщеплять смещенный клапан. FEN1 расщепляет короткий лоскут сразу после того, как они образуют. Расщепление подавляется , когда 5’ — конец лоскута ДНК блокируется либо с комплементарным праймером или биотин-стрептавидин , конъюгированный фрагментом. ДНК — лигазы герметизирует ник сделаны FEN1 и это создает функциональную непрерывную двойную цепь ДНК. PCNA имитирует ферментативные функции белков , как для FEN1 и ДНК — лигазы. Взаимодействие имеет решающее значение в создании правильного лигирования отстающей цепи ДНК. Последовательная цепь смещения и расщепление Pol б и FEN1, соответственно, помогает удалить весь инициатор РНК перед тем лигирования. Многие перемещения должны иметь место и расщепление реакция необходимы для удаления инициатора праймера. Лоскут , который создается и процессы , и выдерживаются короткими закрылки путем.
Длинный Путь закрылков
В некоторых случаях FEN1 длится только в течение короткого периода времени и отсоединяется от комплекса репликации. Это вызывает задержку в расщеплении, что клапаны, перемещенные в результате Pol δ стать долго. Когда РП достигает достаточно большую длину, он может связывать стабильно. Когда РП связаны заслонки refactorized к FEN1 расщеплению Требовать другую нуклеазу для обработки, это было идентифицировано в качестве альтернативной нуклеазы, DNA2. DNA2 имеет дефекты в гиперэкспрессией DEN1. DNA2 показал, работать с FEN1 для обработки длинных лоскутов. DNA2 может диссоциировать РП от длинного лоскута, он делает это с помощью механизма подобно FEN1. Он связывает заслонку и нити 5′ конец заслонки. Нуклеазы расщепляет клапан делает его слишком коротким, чтобы связываться с РПА, лоскут быть слишком коротким означает, что он доступен для FEN1 и лигирование. Это известно как длинный метод закрылка. DNA2 может выступать в качестве FEN1 в качестве резервного для нуклеазы активности, но это не является эффективным процессом.
Альтернативный путь
До недавнего времени существовало только два известных путей для обработки Оказаки фрагментов. Однако современные исследования пришли к выводу, что новый путь для Окадзаки фрагментации и репликации ДНК существует. Этот альтернативный путь включает ферменты, Pol б с PIF1, которые выполняют тот же процесс удаления закрылка как Pol б и FEN1.
Ферменты, участвующие в формировании фрагмента
праймаза
Праймаза добавляет РНК праймеров на отстающей нити, что позволяет синтез фрагментов Okazaki от 5′ к 3′ . Однако, праймаза создает РНК праймеров при гораздо меньшей скоростью , чем та , при которой ДНК — полимераза синтезирует ДНК на ведущей нити. ДНК — полимераза на отстающей нити также должен быть постоянно повторно построить Оказаки фрагментов РНК следующих праймеров. Это делает скорость отстающей синтезы цепи гораздо ниже , чем у ведущей нити. Чтобы решить эту проблему, праймаз выступает в качестве временного сигнала остановки, на короткое время остановить прогрессирование вилки репликации во время репликации ДНК. Этот процесс предотвращает молекулярный ведущую нить от обгона отстающей нити.
ДНК-полимеразы δ
ДНК-полимераза является такой важной частью этого, потому что новая ДНК производится во время этой фазы ферментов, которые синтезируют ДНК в 5′-3′ направления. ДНК-полимераза необходима как для ведущей нити, которая выполнена в виде непрерывной нити и отстающая нить, которая сделана на мелких кусочках в синтезе ДНК. Этот процесс происходит для расширения вновь синтезированного фрагмента и изгнания РНК и ДНК сегмента. Синтез происходит в 3-х фаз с двумя различными полимераз, ДНК-полимеразы альфа-праймаза и ДНК-полимеразы d. Этот процесс начинается с полимера α-праймаза вытесняя из РНК и ДНК праймера с помощью репликации зажим загрузчика влияет, это влияет приводит скользящий зажим на ДНК. После этого ДНК-полимераза δ начинает входить в его холоферменте формы, которые затем синтез начинает. Процесс синтеза будет продолжаться до тех пор, 5’предыдущего фрагмента Оказаки не прибыл. После того, как прибыли, обработка фрагмента Оказаки переходит присоединиться к вновь синтезированный фрагмент к отстающей нити. Последняя функция ДНК-полимеразы б, чтобы служить в качестве дополнения к / RAD27 5′ деятельности FEN1 закрылков эндонуклеазы. Rad27-р аллель смертельна в большинстве комбинаций, но был жизнеспособным с rad27-р-полимеразы и экзо 111. Оба rad27-р-полимеразы и экзо 111 изображают сильный синергетический рост CAN 1 дублирования мутаций. Единственная причина, почему эта мутация является жизнеспособной из-за двунитевым ремонт разрыва генов RAD50, RAD51 и RAD52. RAD27 / FEN1 создает ники между соседними фрагментами Okazaki путем минимизации количества нитей-высылкой в отстающей нити.
ДНК-лигазы I
Во время отстающих синтеза нити, ДНК — лигазы я соединяет фрагменты Оказаки после замены РНК праймеров с нуклеотидов ДНК с помощью ДНК — полимеразы б. Окадзаки фрагменты, которые не лигатурой может привести к двухцепочечной-брейки, который расщепляет ДНК. Поскольку только небольшое количество двунитевых разрывов допускаются, и только небольшое количество может быть отремонтировано, достаточно лигирование отказов могут быть смертельными к ячейке.
Дальнейшее исследование подразумевает дополнительную роль ядерного антигена пролиферирующих клеток (PCNA) к функции ДНК — лигазы I о присоединении Оказаки фрагментов. Когда сайт связывания PCNA на ДНК — лигазы I неактивно, ДНК — лигазы способность I для подключения Оказаки фрагментов сильно нарушена. Таким образом, предлагаемый механизм следующим образом : после того, как PCNA-ДНК — полимеразы δ комплекс синтезирует фрагментов Оказаки, ДНК — полимеразы δ высвобождается. Затем ДНК — лигаза я связываюсь с PCNA, который крепится к зарубкам в отстающей нити и катализирует образование фосфодиэфирных связей.
Закрылков эндонуклеазы 1
Закрылков эндонуклеазы 1 ( FEN1 ) отвечает за обработку фрагментов Оказаки. Он работает с помощью ДНК — полимеразы , чтобы удалить РНК праймер фрагмента Оказаки и может удалить рибонуклеотида и 5′ 5′ закрылков , когда ДНК — полимераза смещает нить во отстающих синтезе нити. Удаление этих заслонок включает в себя процесс , называемый зарубка перевод и создает ник для перевязки. Таким образом, функция FEN1 является необходимым фрагментом Оказаки созревания в формировании длинной непрерывной цепи ДНК. Кроме того, в ходе базовой репарации ДНК, поврежденный нуклеотид смещается в лоскут , а затем удаляют FEN1.
DNA2 эндонуклеазы
DNA2 эндонуклеаза не имеет специфическую структуру, и их свойства не хорошо охарактеризованы, но может быть передана в качестве одноцепочечной ДНК со свободными концами (оцДНК). DNA2 эндонуклеазы необходимо расщеплять длинные закрылки ДНК, которые оставляют FEN1 во время процесса Оказаки. DNA2 эндонуклеазы отвечает за удаление сегмента РНК инициатора на Оказаки фрагментов. Кроме того, DNA2 эндонуклеаза играет ключевую роль в промежуточных созданных в ходе различного метаболизма ДНК и является функциональным в поддержании теломера.
DNA2 эндонуклеазы становится активным, когда сегмент терминала РНК прикрепляется на 5′-конце, так как он транслоцируется в 5′ к 3′ . В присутствии одноцепочечной ДНК-связывающий белок RPA, закрылки ДНК 5′ становятся слишком долго, и ники больше не подходит в качестве субстрата для FEN1. Это предотвращает FEN1 от удаления 5′-закрылков. Таким образом, роль DNA2 является снижение 3′-конца этих фрагментов, что делает возможным для FEN1 отрезать крылышки и Оказаки фрагмент Созревание более эффективной. Во время процесса Оказаков, DNA2 хеликаз и эндонуклеазы неразделимы. DNA2 эндонуклеазы не зависит от 5′-хвостатых вилки структуры его активности. Непродуктивные связывание было известно создавать блоки для FEN1 расщепления и отслеживания. Известно, что АТФ снижает активность, но способствует высвобождению 3′-конца этикетки. Исследования показали, что новая модель DNA2 Эндонуклеазы и FEN1 частично ответственна в фрагменте Оказаки созревания.
Биологическая функция
Вновь синтезированные ДНК, иначе известный как Okazaki фрагменты, связаны ДНК-лигазы, который образует новую цепь ДНК. Есть две нити, которые создаются, когда ДНК синтезируется. Ведущая нить непрерывно синтезируется и вытянута в ходе этого процесса, чтобы выставить шаблон, используемый для отстающей нити (Окадзаки фрагментов). В ходе процесса репликации ДНК, ДНК и РНК-праймеры удаляются из отстающей цепи ДНК, чтобы позволить Фрагменты Оказаки связываться с. Так как этот процесс является настолько распространенным, Окадзаки Созревание пройдет около миллиона раз в течение одного завершения репликации ДНК. Для Окадзаки созревания происходят, РНК-праймеры должны создавать сегменты на фрагменты для лигирования. Это используется в качестве строительного блока для синтеза ДНК в отстающей нити. На матричной нити, полимераза синтезирует в противоположном направлении от репликативной вилки. После того, как шаблон становится прерывистым, она создаст фрагмент Окадзаки. Дефекты в созревании Okazaki фрагментов потенциально могут привести к нити в ДНК ломаться и вызывают различные формы хромосомных аномалий. Эти мутации в хромосомах могут повлиять на внешний вид, количество наборов, или количество отдельных хромосом. Так как хромосомы фиксированы для каждого конкретного вида, он также может изменить ДНК и вызвать дефекты в генофонда этого вида.
Различия в прокариот и эукариот
Фрагменты Оказаки присутствуют в обоих прокариот и эукариот . Молекулы ДНК у эукариот отличаются от круговых молекул прокариот в том , что они больше , и обычно имеют множественные сайты инициации репликации. Это означает , что каждая хромосома эукариот состоит из множества блоков репликации ДНК с несколькими начала репликации. Для сравнения, прокариотическая ДНК имеет только один источник репликации. У эукариот, эти реплицирующиеся вилки, которые являются многочисленными вдоль всей ДНК, форме «пузырей» в ДНК во время репликации. Формы вилки репликации в конкретной точке , называемой автономной репликации последовательности (ARS). Эукариоты имеют зажим загрузчика комплекс и шесть-блок зажать называется ядерный антиген пролиферирующих клеток. Эффективное перемещение вилки репликации также зависит главным образом от быстрого размещения скользящих зажимов на новом загрунтованные участках на отстающей нити ДНК с помощью АТФ-зависимой Хомут погрузчика комплексов. Это означает , что генерация кусочно Окадзаки фрагментов может идти в ногу с непрерывным синтеза ДНК на ведущей нити. Эти клещи погрузчиков комплексы характерны для всех эукариот и отделить некоторые из незначительных различий в синтезе фрагментов Оказаки в прокариот и эукариот. Длины фрагментов Okazaki в прокариот и эукариот различны , а также. Прокариоты имеют Оказаки фрагменты , которые являются довольно длиннее , чем у эукариот. Эукариоты обычно имеют Оказаки фрагменты , которые имеют длину от 100 до 200 нуклеотидов, тогда как фрагменты в прокариотической E.coli , может быть длиной 2000 нуклеотидов. Причина этого расхождения неизвестна.
Каждый эукариотической хромосома состоит из множества реплицирующихся единиц ДНК с несколькими начала репликации. Для сравнения, прокариотическая хромосома E.coli , имеет только один источник репликации. Репликация у прокариот происходит внутри цитоплазмы, и все это начинает репликацию , который образован из примерно от 100 до 200 или более нуклеотидов. Эукариотические ДНК — молекулы имеют значительно большее число репликонов , около 50000 или более; Однако, репликация не происходит одновременно на всех репликонах. У эукариот репликация ДНК происходит в ядре. Форма репликации множества только в одной репликации молекулы ДНК, начало репликации ДНК отодвигаются белком мульти-субъединицы. Эта репликация происходит медленно, а иногда около 100 нуклеотидов в секунду добавляется.
Мы из этого , что прокариотических клеток проще по структуре, они не имеют ядра, органелл, и очень мало ДНК в виде одной хромосомы. Эукариотические клетки имеют ядро с несколькими органеллами и дополнительной ДНК , расположенной в линейных хромосомах. Мы также видим , что размер еще одно различие между этими прокариотических и эукариотических клеток. Средняя эукариот клетка имеет примерно в 25 раз больше ДНК , чем прокариотическая клетка делает. Репликация происходит гораздо быстрее , в прокариотических клетках , чем в клетках эукариот; Бактерии иногда принимать только 40 минут, в то время как клетки животных , могут занимать до 400 часов. Эукариот также имеют различные операции для репликации теломеры в конце последних хромосом. Прокариоты имеют круговые хромосомы, в результате чего нет концов не синтезировать. Прокариоты имеют короткий процесс репликации , который происходит непрерывно; эукариотические клетки, с другой стороны, только осуществить репликацию ДНК во время S-фазе клеточного цикла .
Сходство шаги для репликации ДНК. В обоих прокариот и эукариот, репликация осуществляется путем разматывания ДНК с помощью фермента, называемого ДНК хеликаза. Новые нити создаются с помощью ферментов, называемых ДНК-полимеразы. Оба из них следуют той же схеме, которая называется полу-консервативной репликации, в котором отдельные нити ДНК производятся в разных направлениях, что делает ведущую и отстающей нити. Эти отстающие нити синтезируют путем производства Okazaki фрагментов, которые соединены вместе в ближайшее время. Оба эти организмы начинают новые нити ДНК, которые также включают в себя небольшие пряди РНК.
Использование в технологии
Медицинские понятия, связанные с фрагментами Okazaki
 Незначительная мутация в соответствующих нуклеотидах может привести к хромосомным аберрациям и непреднамеренной генетической перегруппировке
Незначительная мутация в соответствующих нуклеотидах может привести к хромосомным аберрациям и непреднамеренной генетической перегруппировкеХотя клетки претерпевают несколько шагов для того, чтобы гарантировать, что нет никаких мутаций в генетической последовательности, иногда специфические делеции и другие генетические изменения во время созревания фрагмента Оказаки остаются незамеченными. Поскольку Окадзаки фрагменты множество нуклеотидов для отстающей нити, любое изменение в том числе делеций, вставок или дупликации из исходного жгута может вызвать мутацию, если она не обнаружена и исправлена. Другие причины мутаций включают в себя проблемы, связанные с белками, которые помогают в репликации ДНК. Например, мутация связана с праймаза влияет на удаление РНК праймера и может сделать нить ДНК более хрупкими и подвержены разрывам. Еще одна мутация касается полимеразы α, что ухудшает редактирование последовательности фрагмента Оказаки и включение белка в генетический материал. Оба изменения могут привести к хромосомных аберраций, непреднамеренной генетической перестройкой и различных видов рака в более позднем возрасте.
Для того , чтобы проверить влияние белковых мутаций на живых организмах, исследователи генетически измененные лабораторный мышей гомозиготные по другой мутации белка , связанной с репликацией ДНК, закрылки эндонуклеазой 1 , или FEN1. Результаты изменяются на основании специфических изменений генов. Гомозиготная выколотки мутантных мышей испытали «провал пролиферации клеток» и «ранней эмбриональной летальности» (27). Мыши с мутацией F343A и F344A (также известной как FFAA) умер сразу после рождения из — за осложнения во время родов , включая панцитопению и легочную гипоплазию . Это происходит потому , что мутация FFAA предотвращает FEN1 от взаимодействия с PCNA (ядерный антиген пролиферирующих клеток), следовательно , не позволяет ему завершить свою задачу во время созревания фрагмента Оказаки. Взаимодействие с этим белком считается ключевой молекулярной функцией биологической функции FEN1 в. Мутация FFAA вызывает дефекты удаления грунтовочного РНК и долгосрочной основы ремонта пары, из которых вызывают много разрывов в ДНК. Под тщательным наблюдением, клетки , гомозиготные по FFAA FEN1 мутации , кажется , чтобы отобразить только частичные дефекты созревания, то есть мышей , гетерозиготных по мутации могли бы выжить во взрослую жизнь, несмотря на поддержание нескольких небольших вмятин в их геномах. Неизбежно , однако, эти ники предотвратить будущую репликацию ДНК , поскольку разрыв приводит вилку репликации к коллапсу и вызывает двойные разрывы цепи в фактической последовательности ДНК. Со временем эти ники также вызывают полные разрывы хромосом, которые могут привести к серьезным мутациям и раку. Другие мутации были реализованы с измененными версиями полимеразной а, что приводит к аналогичным результатам.
Рекомендации
- Инмэн РБ, Schnos М, структура точек ветвления в реплицирующейся ДНК: Наличие одноцепочечных соединений в лямбда — ДНК точек ветвления. J. Mol Biol. 56: 319-625, 1971.
- Thommes Р, репликация Hubscher U. эукариотической ДНК. Ферменты и белки , действующие на развилке. Евро. J. Biochem. 194 (3): 699-712, 1990.
внешняя ссылка
- ^ «Хромосомные аберрации.» Биология Справочник, www.biologyreference.com/Ce-Co/Chromosome-Aberrations.html. Купер, Джеффри М. «Репликация ДНК.» Current Неврология и Neuroscience Reports., США Национальная медицинская библиотека, 1 января 1970, www.ncbi.nlm.nih.gov/books/NBK9940/. «Окадзаки Фрагменты.» NeuroImage, Academic Press, www.sciencedirect.com/topics/biochemistry-genetics-and-molecular-biology/okazaki-fragments. Prentice Hall Bridge Page, www.phschool.com/science/biology_place/biocoach/dnarep/glossary.html.
