Соль Эпсома, или английская горькая соль и другие соединения магния
В природе английская соль содержится в воде многих горьких минеральных источников, из которых её раньше и добывали.
Сульфат магния, магний сернокислый. Другие названия — английская соль, горькая соль, магнезия, соль Эпсома.
Варианты использования:
— Как слабительное. Назначают внутрь (на ночь или натощак — за полчаса до еды), взрослым по
10-30 г в полстакане воды, детям из расчета 1 г на 1 год жизни. При
хронических запорах могут применяться клизмы (100 мл 20-30 %).
Эта соль не впитывается организмом, является великолепным сорбентом,
впитывая всю грязь из кишечника и выводит ее наружу. Слабительное очень
мягкое, но эффективное.
— Скраб для лица и тела. Из сульфата магния можно быстро приготовить скраб для лица. Для этого потребуется немного любого увлажняющего крема и равное количество английской соли. Аккуратно перемешиваем смесь до получения гомогенной консистенции, затем наносим на лицо, как это мы делаем при пользовании обычными скрабами. Оставляем на 3 минуты, затем смываем теплой водой. Использование такого скраба позволяет глубоко очистить лицо, избавиться от угрей. Особенно полезно регулярное применение скраба из магнезии людям с очень жирной кожей. Можно приготовить также скраб с магнезией для всего тела. Для это нужно смешать столовую ложку крема для тела с таким же количеством сульфата магния. Полученную смесь нанести на тело, оставить на 3-5 минут, после этого смыть. Процедура очень приятная и полезная. Очень скоро вы заметите, что ваша кожа стала более упругой, ухоженной и привлекательной.
— Для объёма волос. Смешайте в равных частях английскую соль и кондиционер для волос. Нанесите смесь на волосы на 20 минут. Промойте водой.
— Для расслабляющих ванн. Средство для снятия стресса в конце напряженного дня, успокоения нервов. Два стакана соли на горячую ванну. Считается, что английская соль даже проясняет ум! Такой эффект у этой ванны. А ещё ванная с английской солью очищает от токсинов и избавляет от головной боли. В ванну можно добавлять масла или эфирные масла для аромата. Такую ванну можно принимать три раза в неделю, по 12 минут.
— Ножные ванны. Ножная ванна из тёплой воды и английской соли избавляет от боли в ногах, а также устраняет запах пота и смягчает кожу. Для этого добавьте 1/2 стакана английской соли в тазик с тёплой водой. Опустите ноги в воду и держите их там как угодно долго, но не менее 15 минут. После ножной ванны вы почувствуете расслабленность, а кожа на ногах станет мягкой и чистой. Ополосните ноги чистой водой и высушите полотенцем. Ножную ванну можно делать перед педикюром для очищения и смягчения кожи.
— Извлечение заноз и жал насекомых из кожи.
— Боли в мышцах. Соль выводит жидкости из организма и уменьшает отек тканей. Вместе с жидкостью через кожу организм покидает и молочная кислота, накопление которой способствует возникновению мышечных болей. Примите расслабляющую горячую ванну, предварительно добавив в воду одну — две чашки соли Эпсома.
— Детоксикация организма. В этом рецепте основной удар идет за счет применения английской соли.
Ингредиенты на стандартную ванну:
морская соль — 1 стакан
английская соль — 2 стакана
сода пищевая — 1/2 стакана
эфирные масла — 10 капельВсе ингредиенты нужно предварительно смешать, затем добавить эфирные масла и окончательно перемешать состав для ванны. Если вы добавите еще и 1/2 стакана лимонной кислоты, то у вас получится воздушно-шипящая ванна, которая будет пенится за счет реакции ингредиентов.
После принятия ванны с английской солью будет чувство изможденности. Ваш организм настолько очистится , что будет требовать покоя и сна. Поэтому принимать такую ванну нужно только перед сном!
— Плоский живот. Бороться с лишним жиром можно не только с помощью ванны, но и используя обертывания. Это обертывание хорошо уменьшает жир и делает кожу подтянутой и гладкой. Смешать:
¼ стакана воды
1 столовую ложку соли английской
10 капель мятного или ментолового масла
Смесь хорошо перемешать и смочить в ней кусок хлопчатобумажной ткани. С
— Лак для волос. Смешать 1 стакан горячей воды, 2 столовые ложки соли, 1 чайную ложку геля алоэ вера, и 1/2 чайной ложки кондиционера для волос. Перелить в бутылку с распылителем.
— Акне. Если вы
страдаете акне, соль поможет удалить омертвевшие частички кожи, лишний
жир и немного подлечит кожу – как ластик подотрет следы от угревой сыпи.
Сульфат магния содержит магний в биодоступной форме, который
впитывается кожей и расслабляет мускулы, снимает напряжение и уменьшает
воспалительные процессы. Отлично смягчает чувствительную и раздраженную
кожу, создает на ней слабощелочную среду, защищая от инфекций.
Смешайте половину чайной ложки английской соли с вашим средством для умывания и помассируйте лицо.
— После загара. Растворить две столовые ложки английской соли в 1 стакане воды и распылить на незначительные ожоги.
— Удобрение. Приходилось ли вам наблюдать, что листья у томатов или перцев желтеют? Хотелось бы более пышного цветения на кустах роз? Любопытно узнать, почему ваш газон выглядит скорее коричневым, чем зеленым? Эти проблемы могут возникать в результате нехватки магния в почве. А это, в свою очередь, не позволяет корням поглощать необходимые питательные вещества. Дайте вашему саду подпитку с помощью английской соли:
Комнатные растения: Используйте две столовые ложки на литр воды; для ежемесячной подкормки растений.
Розы: Используйте одну столовую ложку на каждые 30 см. высоты растения; применять каждые 2 недели. Также посыпьте 1 / 2 стакана в почву у основания растения, чтобы цветение стало более пышным. Замочите саженцы кустов в одной чашке английской соли на литр воды, чтобы помочь укрепить корни. Добавьте одну столовую ложку английской соли в каждую лунку при посадке.
Помидоры и перец: Используйте 1 столовую ложку на каждые 30 см. высоты растения; применять каждые 2 недели, чтобы избежать пожелтения листьев.
Цветущие растения: Добавить 1 столовую ложку английской соли на 1 литр воды. Эта смесь помогает войти цвету в силу.
Газоны: Применить 1.36 килограмм на каждые 116 квадратных метров. Посыпать или распылить, разбавив в воде.
Кустарники (вечнозеленые растения, азалии, рододендроны): Используйте 1 столовую ложку на каждые 9 квадратных метров. Применяйте в корневой зоне каждые 2-4 недели.
Магний и сульфат – основные компоненты английской соли, они помогают восстанавливать необходимый уровень питательных веществ в почве. Хотя магний и сульфат встречаются в почве, но со временем они могут быть исчерпаны. Английская соль также может способствовать прорастанию семян и производству хлорофилла, используемого для преобразования солнечной энергии в пищу. Кроме того, английская соль ускоряет поглощение фосфора и азота, двух из наиболее важных компонентов удобрений.
— Стабилизатор. Стабилизирует эмульсии, богатые маслами, типа «вода-в-масле».
psm 20/08/13 #304 3/08/14Английская соль и способы ее применения
Английская соль это та вещь, которую стоит иметь всегда под рукой, потому что она может помочь нам не только быть здоровее, но и сэкономить много денег. Английская соль, известная также как горькая соль, получила свое название потому, что в Англии эту соль выпаривали из бьющих там источников.
Химически это соединение серы и магния. Оно благотворно влияет на организм человека. Английская соль содержит серу, а сера, как известно, друг красоты: она делает волосы и ногти крепкими, а кожу сияющей.
Английская соль похожа на поваренную соли (хлорида натрия), но горькая на вкус (отсюда и название), не имеет запаха, имеет нейтральный рН для кожи, перорально действует как осмотическое слабительное (в меньших дозах как желчегонное).
Свойства английской соли
Благодаря содержанию ионов магния и серы соль оказывает различное воздействие на организм: очищает, омолаживает, смягчает, оказывает антибактериальное действие. Она лучше всасывается через кожу, чем через пищеварительный тракт, когда принимается в виде таблеток.
Почему мы нуждаемся в сере? Сера участвует в ряде процессов в организме. Она предотвращает кератоз, распространенное поражения кожи, она необходима для сильных волос и ногтей, здоровья суставов и кожи головы. Кроме того, соединения серы имеют большое значение в связывании и удалении тяжелых металлов из организма, которые ежедневно поступают в тело из-за загрязнения окружающей среды (воздух, вода, продукты питания). Сера также важна для для выработки глутатиона и металлотионеина (которые устраняют молекулы токсичных металлов).
Использование эпсомской соли
Английская соль на протяжении веков имела множество применений: на кухне, в ванной и в саду. Сегодня английская соль может послужить как:
- Слабительное. Необходимо растворить неполную столовую ложку английской соли в стакане теплой воды и выпить (вкус отвратительный, но это работает). Ее можно применять для опорожнения кишечника перед диагностическими процедурами желудочно-кишечного тракта или перед операцией. Тем не менее не стоит использовать английскую соль как слабительные каждый день. Для регулярного стула следует нормализовать рацион, добавив в него продукты с высоким содержанием клетчатки.
- Репеллент для улиток в саду. Просто посыпьте английской солью участок, и незваные гости не нарушат ваши владения.
- Природный пестицид. Раствор английской соли распыляют на растения, чтобы избавиться от насекомых.
- Удобрение. Английская соль способна «лечить» почву. Особенно полезна она для хвойных деревьев или удобрения газона. Как правило, это помогает росту всех цветов и овощей: достаточно просто поливать их водой с английской солью (столовая ложка соли на 2 литра воды).
- Средство для смягчения воды при стирке. В 4 ложки сульфата магния добавить 20-25 капель вашего любимого эфирного масла, засыпать в стиральную машину.
- Средство против комариных укусов. В стакане воды растворить 2 столовые ложки английской соли, смочить марлю или пеленку и сделать обертывание.
- Средство для загара и против солнечных ожогов. Как и в случае с комарами необходимо растворить 2 столовые ложки эпсомской соли в стакане воды и опрыскивать раздраженную кожу.
- Средство против мышечных болей, артрита, головных болей и общей усталости. Для хорошего самочувствия в ванну с горячей водой добавить 2 стакана английской соли и выдержать в течение 15-20 минут. Для полного расслабления вы можете добавить в воду ваши любимые эфирные масла. Ванна с английской соли действует расслабляюще, поэтому может быть использована также детьми для хорошего сна.
- Скраб для тела. Горстку сульфата магнезии смешать с оливковым или кокосовым маслом, можно добавить несколько капель вашего любимого эфирного масла.
- Скраб для лица. Половина чайной ложки английской соли смешать с небольшим количеством масла миндаля, геля для умывания или добавить в крем для лица. Если смешать соль в равных частях с медом, получится пилинг-маска: держите маску в течение 15-20 минут.
- Как средство для чистки плитки и кафеля. Смешать в равных частях английскую соль и жидкость для мытья полов и кафеля.
- Средство для красивых волос. Смешать в равных частях органический лосьон для волос и английскую соль, равномерно нанести смесь в качестве маски на слегка влажные волосы, через 20 минут тщательно промыть водой. Такая маска визуально увеличивает объем волос.
- Удаление осколков из ран. Опустить порезанный палец в растворе соли. Это смягчает кожу и способствует извлечению осколков.
- Средство для уставших и опухших ног. После долгого дня ванна для ног расслабляет и успокаивает уставшие ноги. Просто добавьте несколько столовых ложек соли в миску с водой. Ванна с солью также поможет при отеках и боли при растяжения и ушибах.
- Средство против грибка и неприятного запаха ног. Ноги замочить в растворе английской соли (несколько столовых ложек на миску воды), держать ноги в течение 10-15 минут. Эта процедура помогает избавиться от проблемы неприятного запаха и грибка. При лечении онихомикоза ванну нужно применять 3 раза в день.
Хлорид натрия — Википедия
| Хлорид натрия | |
|---|---|
 ( ({{{картинка3D}}}) | |
 ( ({{{изображение}}}) | |
| Систематическое | Хлорид натрия |
| Традиционные названия | Соль, поваренная соль, столовая соль, пищевая соль, каменная соль, галит[1] |
| Хим. формула | NaCl |
| Молярная масса | 58,44277 г/моль |
| Плотность | 2,165 г/см³ |
| Температура | |
| • плавления | 800,8 °C |
| • кипения | 1465 °C |
| Мол. теплоёмк. | 50,8 Дж/(моль·К) |
| Энтальпия | |
| • образования | −234,8 кДж/моль |
| Удельная теплота испарения | 170,85 кДж/моль |
| Удельная теплота плавления | 28,68 кДж/моль |
| Растворимость | |
| • в воде | 35,6 г/100 мл (0 °C) 35,9 г/100 мл (+25 °C) 39,1 г/100 мл (+100 °C) |
| • в метаноле | 1,49 г/100 мл |
| • в аммиаке | 21,5 г/100 мл |
| Показатель преломления | 1,544202 (589 нм) |
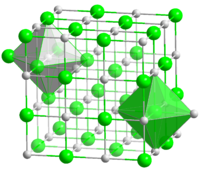
| Координационная геометрия | Октаэдральная (Na +) Октаэдральная (Cl -) |
| Кристаллическая структура | гранецентрированная кубическая, cF8 |
| Рег. номер CAS | 7647-14-5 |
| PubChem | 5234 |
| Рег. номер EINECS | 231-598-3 |
| SMILES | |
| InChI | |
| RTECS | VZ4725000 |
| ChEBI | 26710 |
| ChemSpider | 5044 |
| ЛД50 | 3000–8000 мг/кг |
| NFPA 704 |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
 Кристалл хлорида натрия
Кристалл хлорида натрияХлори́д на́трия или хлористый натрий (NaCl) — натриевая соль соляной кислоты. Известен в быту под названием поваренной соли, основным компонентом которой и является. Хлорид натрия в значительном количестве содержится в морской воде[⇨]. Встречается в природе в виде минерала галита (каменной соли). Чистый хлорид натрия представляет собой бесцветные кристаллы, но с различными примесями его цвет может принимать голубой, фиолетовый, розовый, жёлтый или серый оттенок.
В природе хлорид натрия встречается в виде минерала галита, который образует залежи каменной соли среди осадочных горных пород, прослойки и линзы на берегах солёных озёр и лиманов, соляные корки в солончаках и на стенках кратеров вулканов и в сольфатарах. Огромное количество хлорида натрия растворено в морской воде. Мировой океан содержит 4 × 1015 тонн NaCl, то есть из каждой тонны морской воды можно получить в среднем 1,3 кг хлорида натрия. Следы NaCl постоянно содержатся в атмосфере в результате испарения брызг морской воды. В облаках на высоте полтора километра 30 % капель, больших 10 мкм по размеру, содержат NaCl. Также он найден в кристаллах снега[2].
Наиболее вероятно, что первое знакомство человека с солью произошло в лагунах тёплых морей или на соляных озёрах, где на мелководье солёная вода интенсивно испарялась под действием высокой температуры и ветра, а в осадке накапливалась соль. По образному выражению Пифагора, «соль была рождена благородными родителями: солнцем и морем»[3].
Галит[править | править код]
В природе хлорид натрия чаще всего встречается в виде минерала галита. Он имеет гранецентрированную кубическую решётку и содержит 39,34 % Na, 60,66 % Cl. Другими химическими элементами, входящими в состав примесей, являются: Br, N, H, Mn, Cu, Ga, As, I, Ag, Ba, Tl, Pb, K, Ca, S, O. Плотность 2,1—2,2 г/см³, а твёрдость по шкале Мооса — 2. Бесцветный прозрачный минерал со стеклянным блеском. Распространённый минерал соленосных толщ. Образуется при осаждении в замкнутых водоёмах, а также как продукт сгона на стенках кратеров вулканов. Составляет пласты в осадочных породах лагунных и морских фаций, штокоподобные тела в соляных куполах и тому подобных.[4]
Каменная соль[править | править код]
Каменной солью называют осадочную горную породу из группы эвапоритов, состоящую более чем на 90 % из галита. Галит также часто называют каменной солью. Эта осадочная горная порода может быть бесцветной или снежно-белой, но чаще она окрашена примесями глин, талька (серый цвет), оксидами и гидроксидами железа (жёлтый, оранжевый, розовый, красный), битумами (бурая). Каменная соль содержит хлориды и сульфаты натрия, калия, магния и кальция, бромиды, иодиды, бораты, гипс, примеси карбонатно-глинистого материала, доломита, анкериту, магнезита, битумов и так далее[4].
По условиям формирования месторождений каменную соль подразделяют на следующие виды[4]:
- рассолы современных соляных бассейнов
- соляные подземные воды
- залежи минеральных солей современных соляных бассейнов
- ископаемые залежи (важнейшие для промышленности).
Морская соль[править | править код]
Морская соль является смесью солей (хлориды, карбонаты, сульфаты и т. д.), образующейся при полном испарении морской воды. Среднее содержание солей в морской воде составляет:
| Соединение | Масс. доля, % |
|---|---|
| NaCl | 77,8 |
| MgCl2 | 10,9 |
| MgSO4 | 4,7 |
| KCl | 2,5 |
| K2SO4 | 2,5 |
| CaCO3 | 0,3 |
| Ca(HCO3)2 | 0,3 |
| другие соли | 0,2 |
 Очищенная кристаллическая морская соль
Очищенная кристаллическая морская сольПри испарении морской воды при температуре от +20 до +35 °C в осадке сначала кристаллизуются наименее растворимые соли — карбонаты кальция и магния и сульфат кальция. Затем выпадают более растворимые сульфаты натрия и магния, хлориды натрия, калия и магния, и после них — сульфаты калия и магния. Последовательность кристаллизации солей и состав осадка может несколько варьироваться в зависимости от температуры, скорости испарения и других условий. В промышленности морскую соль получают из морской воды, в основном методом обычного выпаривания. Она отличается от каменной соли значительно большим содержанием других химических солей, минералов и различных микроэлементов, в первую очередь йода, калия, магния и марганца. Соответственно, она отличается от хлорида натрия и по вкусу — горько-солёный привкус ей придают соли магния. Она используется в медицине: при лечении кожных заболеваний, таких как псориаз. Как лечебное вещество в аптечной и обычной торговой сети, распространённым продуктом является соль из Мёртвого моря. В очищенном виде этот вид соли также предлагается в продуктовой торговой сети — как натуральная и богатая йодом пищевая[5].
Залежи[править | править код]
Залежи каменной соли найдены во всех геологических системах. Важнейшие из них сосредоточены в кембрийских, девонских, пермских и третичных отложениях. Каменная соль составляет мощные пластовые залежи и ядра сводчатых структур (соляных куполов и штоков), образует прослойки, линзы, гнезда и вкрапления в других породах[4]. Среди озёрных месторождений России крупнейшие — Эльтонское, Баскунчак в Прикаспии, Кучукское озеро, Кулундинское озеро, Эбейты и другие озёра в Западной Сибири.
Производство[править | править код]
В древности технология добычи соли заключалась в том, что соляную рапу (раствор) вытаскивали лошадиным приводом из шахт, которые назывались «колодцами» или «окнами», и были достаточно глубокими — 60—90 м. Извлечённый солевой раствор выливали в особый резервуар — творило, откуда она через отверстия стекала в нижний резервуар, и системой жёлобов подавалась в деревянные башни. Там её разливали в большие чаны, на которых соль вываривали.
На Руси поморы вываривали соль на побережье Белого моря и называли её морянка. В 1137 году новгородский князь Святослав определил налог на соляные варницы[6]:
 | …на мори от чрена и от салгы по пузу…[7] |  |
Беломорской солью, называемой «морянкой», торговали по всей Российской империи до начала XX века, пока её не вытеснила более дешёвая поволжская соль.
Современная добыча хлорида натрия механизирована и автоматизирована. Соль массово добывается выпариванием морской воды (тогда её называют морской солью) или рассола с других ресурсов, таких как соляные источники и соляные озера, а также разработкой соляных шахт и добычей каменной соли.
Для добычи хлорида натрия из морской воды необходимы условия жаркого климата с низкой влажностью воздуха, наличие значительных низменных территорий, лежащих ниже уровня моря, или затопляемых приливом, слабая водопроницаемость почвы испарительных бассейнов, малое количество осадков в течение сезона активного испарения, отсутствие влияния пресных речных вод и наличие развитой транспортной инфраструктуры.
Мировое производство соли в 2009 году оценивается в 260 миллионов тонн. Крупнейшими мировыми производителями являются Китай (60,0 млн тонн), США (46,0 млн тонн), Германия (16,5 млн тонн), Индия (15,8 млн тонн) и Канада (14 млн тонн)[8].
-

Добыча соли в южной части Мертвого моря, Израиль
-

Кристаллы каменной соли
-

Плантация морской соли в Дакаре
-

Соляные кучи на солончаке Уюни, Боливия
В пищевой промышленности и кулинарии[править | править код]
Соль повареннаяВ пищевой промышленности и кулинарии используют хлорид натрия, чистота которого должна быть не менее 97 %. Его применяют как вкусовую добавку и для консервирования пищевых продуктов. Такой хлорид натрия имеет товарное название поваренная соль, порой также употребляются названия пищевая, столовая, а также уточнение названия в зависимости от её происхождения — каменная, морская, и по составу добавок — йодированная, фторированная и т. д. Такая соль является кристаллическим сыпучим продуктом с солёным вкусом без привкуса, без запаха (за исключением йодированной соли), в котором не допускаются посторонние примеси, не связанные с методом добывания соли. Кроме хлорида натрия, поваренная соль содержит небольшое количество солей кальция, магния, калия, которые придают ей гигроскопичности и жёсткости. Чем меньше этих примесей в соли, тем выше её качество.
Выделяют сорта: экстра, высший, первый и второй. Массовая доля хлористого натрия в сортах, %:
- экстра — не менее 99,5;
- высший — 98,2;
- первый — 97,5;
- второй — 97,0.
Массовая доля влаги в выварочной соли сорта «экстра» 0,1 %, в высшем сорте — 0,7 %. Допускают добавки йодида калия (йодистого калия), йодата калия, фторидов калия и натрия. Массовая доля йода должна составлять (40,0 ± 15,0) × 10−4 %, фтора (25,0 ± 5,0) × 10−3 %. Цвет экстра и высшего сортов — белый, однако для первого и второго допускается серый, желтоватый, розовый и голубоватый оттенки в зависимости от происхождения соли. Пищевую поваренную соль производят молотой и сеяной. По размеру зёрен молотую соль подразделяют на номера: 0, 1, 2, 3. Чем больше номер, тем больше зерна соли.
В кулинарии хлорид натрия потребляют как важнейшую приправу. Соль имеет характерный вкус, без которого пища кажется человеку пресной. Такая особенность соли обусловлена физиологией человека. Однако зачастую люди потребляют соли больше, чем нужно для физиологических процессов.
Хлорид натрия имеет слабые антисептические свойства — 10-15%-ное содержание соли предотвращает размножение гнилостных бактерий. Этот факт обусловливает её широкое применение как консерванта.
В медицине[править | править код]
Изотонический раствор хлорида натрия в воде (0,9 %) применяется как дезинтоксикационное средство, для коррекции состояния систем организма в случае обезвоживания, как растворитель других лекарственных препаратов. Гипертонические растворы (10 % раствор) используют как вспомогательный осмотический диуретик при отёке головного мозга, для поднятия давления при кровотечениях, в состояниях, характеризующихся дефицитом ионов натрия и хлора, при отравлении нитратом серебра, для обработки гнойных ран (местно). В офтальмологии как местное средство раствор хлорида натрия обладает противоотёчным действием[9].
В коммунальном хозяйстве. Техническая соль[править | править код]
Зимой хлорид натрия, смешанный с другими солями, песком или глиной — так называемая техническая соль — применяется как антифриз против гололёда. Ею посыпают тротуары, хотя это отрицательно влияет на кожаную обувь и техническое состояние автотранспорта ввиду коррозийных процессов.
Регенерация Nа-катионитовых фильтров[править | править код]
Nа-катионитовые фильтры широко применяются в установках умягчения воды всех мощностей при водоподготовке. Катионитным материалом на современных водоподготовительных установках служат в основном глауконит, полимерные ионообменные смолы и сульфированные угли. Наиболее распространены сульфокатионитные ионообменные смолы.
Регенерацию Nа-катионитовых фильтров осуществляют 6—10%-м раствором поваренной соли, в результате катионит переводится в Na-форму, регенерируется. Реакции идут по уравнениям:
- CaR2+2NaCl→2NaR+CaCl2{\displaystyle {\mathsf {CaR_{2}+2NaCl\rightarrow 2NaR+CaCl_{2}}}}
- MgR2+2NaCl→2NaR+MgCl2{\displaystyle {\mathsf {MgR_{2}+2NaCl\rightarrow 2NaR+MgCl_{2}}}}
Химическая промышленность[править | править код]
Соль, наряду с каменным углём, известняками и серой, образует «большую четвёрку» продуктов минерального сырья, которые являются важнейшими для химической промышленности[10]. Из неё получают соду, хлор, соляную кислоту, гидроксид натрия, сульфат натрия и металлический натрий. Кроме этого соль используется также для промышленного получения легкорастворимого в воде хлората натрия, который является средством для уничтожения сорняков[11]. Суммарное уравнение реакции электролиза горячего раствора хлорида натрия[12]:
- NaCl+3h3O→NaClO3+3h3{\displaystyle {\mathsf {NaCl+3H_{2}O\rightarrow NaClO_{3}+3H_{2}}}}
Получение хлора и гидроксида натрия[править | править код]
В промышленности путём электролиза раствора хлорида натрия получают хлор. Процессы, происходящие на электродах[13][14]:
- на катоде как побочный продукт выделяется водород вследствие восстановления ионов H+, образованных в результате электролитической диссоциации воды:
- h3O⇄H++OH−{\displaystyle {\mathsf {H_{2}O\rightleftarrows H^{+}+OH^{-}}}}
- 2H++2e−→h3{\displaystyle {\mathsf {2H^{+}+2e^{-}\rightarrow H_{2}}}}
- поскольку (вследствие практически полной электролитической диссоциации NaCl), хлор в растворе находится в виде хлорид-ионов, они окисляются на аноде до свободного хлора в виде газа:
- NaCl→Na++Cl−{\displaystyle {\mathsf {NaCl\rightarrow Na^{+}+Cl^{-}}}}
- 2Cl−→Cl2+2e−{\displaystyle {\mathsf {2Cl^{-}\rightarrow Cl_{2}+2e^{-}}}}
- суммарная реакция:
- 2NaCl+2h3O→2NaOH+Cl2↑+ h3↑{\displaystyle {\mathsf {2NaCl+2H_{2}O\rightarrow 2NaOH+Cl_{2}\!\uparrow +\ H_{2}\!\uparrow }}}
Как видно из уравнения суммарной реакции, ещё одним продуктом является гидроксид натрия. Расход электроэнергии на 1 т хлора составляет примерно 2700 кВт × час. Полученный хлор при повышенном давлении сжижается в жёлтую жидкость уже при обычной температуре[15].
Если между анодом и катодом нет диафрагмы, то растворённый в воде хлор начинает реагировать с гидроксидом натрия, образуя хлорид и гипохлорит натрия NaClO[14]:
- 2NaOH+Cl2→NaCl+NaOCl+h3O{\displaystyle {\mathsf {2NaOH+Cl_{2}\rightarrow NaCl+NaOCl+H_{2}O}}}
Поэтому для получения гидроксида натрия применяют диафрагму и соответствующий метод получения NaOH называют диафрагменным. В качестве диафрагмы применяют асбестовый картон. В процессе электролиза раствор хлорида натрия постоянно подаётся в анодное пространство, а из катодного пространства непрерывно вытекает раствор хлорида и гидроксида натрия. Во время выпаривания последнего хлорид кристаллизуется, поскольку его растворимость в 50 % растворе NaOH крайне мала (0,9 %). Полученный раствор NaOH выпаривают в железных чанах, затем сухой остаток переплавляют.
Для получения чистого гидроксида натрия (без добавок хлорида натрия) применяют ртутный метод, где используют графитовый анод и ртутный катод. Вследствие того, что перенапряжение выделения водорода на ртути очень большое, на ней вновь появляются ионы натрия и образуется амальгама натрия[14][16]:
- Na++e−→Na(Hg){\displaystyle {\mathsf {Na^{+}+e^{-}\rightarrow Na_{(Hg)}}}}
Амальгаму позже разлагают горячей водой с образованием гидроксида натрия и водорода, а ртуть перекачивают насосом обратно в электролизер:
- 2Na(Hg)+2h3O→2NaOH+h3↑{\displaystyle {\mathsf {2Na_{(Hg)}+2H_{2}O\rightarrow 2NaOH+H_{2}\!\uparrow }}}
Суммарная реакция процесса такая же, как и в случае диафрагменного метода.
Получение металлического натрия[править | править код]
Металлический натрий получают электролизом расплава хлорида натрия. Происходят следующие процессы:
- на катоде выделяется натрий:
- Na++e−→Na{\displaystyle {\mathsf {Na^{+}+e^{-}\rightarrow Na}}}
- на аноде выделяется хлор (как побочный продукт):
- 2Cl−→Cl2+2e−{\displaystyle {\mathsf {2Cl^{-}\rightarrow Cl_{2}+2e^{-}}}}
- суммарная реакция:
- 2Na++2Cl−→2Na+Cl2{\displaystyle {\mathsf {2Na^{+}+2Cl^{-}\rightarrow 2Na+Cl_{2}}}}
Ванна электролизера состоит из стального кожуха с футеровкой, графитового анода и кольцевого железного катода. Между катодом и анодом располагается сетчатая диафрагма. Для снижения температуры плавления NaCl (+800 °C), электролитом является не чистый хлорид натрия, а его смесь с хлоридом кальция CaCl 2 (40:60) с температурой плавления +580 °C. Металлический натрий, который собирается в верхней части катодного пространства, содержит до 5 % примесь кальция, но последний со временем почти полностью отделяется, поскольку его растворимость в жидком натрии при температуре его плавления (+371 K = 98 °C) составляет всего 0,01 %. С расходованием NaCl его постоянно добавляют в ванну. Затраты электроэнергии составляют примерно 15 кВт × ч на 1 кг натрия[17].
Получение соляной кислоты и сульфата натрия[править | править код]
Среди многих промышленных методов получения соляной кислоты, то есть водного раствора хлороводорода (HCl), применяется реакция обмена между твёрдым хлоридом натрия и концентрированной серной кислотой:
- NaCl+h3SO4 →t<110oC NaHSO4+HCl↑{\displaystyle {\mathsf {NaCl+H_{2}SO_{4}\ {\xrightarrow {t<110^{o}C}}\ NaHSO_{4}+HCl\uparrow }}}
- NaCl+NaHSO4 →450−800oC Na2SO4+HCl↑{\displaystyle {\mathsf {NaCl+NaHSO_{4}\ {\xrightarrow {450-800^{o}C}}\ Na_{2}SO_{4}+HCl\uparrow }}}
Первая реакция происходит в значительной степени уже при обычных условиях, а при слабом нагреве идёт почти до конца. Вторая происходит лишь при высоких температурах. Процесс осуществляется в специальных механизированных печах большой мощности. Хлороводород, который выделяется, обеспыливают, охлаждают и поглощают водой с образованием соляной кислоты. Как побочный продукт образуется сульфат натрия Na2SO4[18][19].
Этот метод применяется также для получения хлороводорода в лабораторных условиях.
Физические и физико-химические свойства[править | править код]
Температура плавления +800,8 °С, кипения +1465 °С.
Умеренно растворяется в воде, растворимость мало зависит от температуры: коэффициент растворимости NaCl (в граммах на 100 г воды) равен 35,9 при +21 °C и 38,1 при +80 °C. Растворимость хлорида натрия существенно снижается в присутствии хлороводорода, гидроксида натрия, солей — хлоридов металлов. Растворяется в жидком аммиаке, вступает в реакции обмена. В чистом виде хлорид натрия не гигроскопичен. Однако соль часто бывает загрязнена примесями (преимущественно ионами Ca2+, Mg2+ и SO2−
4), и такая соль на воздухе сыреет[20]. Кристаллогидрат NaCl · 2H2O можно выделить при температуре ниже +0,15 °C[21].
Смесь измельчённого льда с мелким порошком хлорида натрия является эффективным охладителем. Так, смесь состава 30 г NaCl на 100 г льда охлаждается до температуры −20 °C. Это происходит потому, что водный раствор соли замерзает при температуре ниже 0 °C. Лёд, имеющий температуру около 0 °C, плавится в таком растворе, поглощая тепло окружающей среды.
| Термодинамические характеристики | |
|---|---|
| ΔfH0g | −181,42 кДж/моль |
| ΔfH0l | −385,92 кДж/моль |
| ΔfH0s | −411,12 кДж/моль |
| ΔfH0aq | −407 кДж/моль |
| S0g, 1 bar | 229,79 Дж/(моль·K) |
| S0l, 1 bar | 95,06 Дж/(моль·K) |
| S0s | 72,11 Дж/(моль·K) |
Диэлектрическая проницаемость NaCl — 6,3
Плотность и концентрация водных растворов NaCl
| Концентрация, % | Концентрация, г/л | Плотность, г/мл |
|---|---|---|
| 1 | 10,05 | 1,005 |
| 2 | 20,25 | 1,012 |
| 4 | 41,07 | 1,027 |
| 6 | 62,47 | 1,041 |
| 8 | 84,47 | 1,056 |
| 10 | 107,1 | 1,071 |
| 12 | 130,2 | 1,086 |
| 14 | 154,1 | 1,101 |
| 16 | 178,5 | 1,116 |
| 18 | 203,7 | 1,132 |
| 20 | 229,5 | 1,148 |
| 22 | 256 | 1,164 |
| 24 | 283,2 | 1,18 |
| 26 | 311,2 | 1,197 |
Лабораторное получение и химические свойства[править | править код]
При действии концентрированной серной кислоты на твёрдый хлорид натрия выделяется хлороводород:
- 2NaCl+h3SO4→t>110oCNa2SO4+2HCl↑{\displaystyle {\mathsf {2NaCl+H_{2}SO_{4}{\xrightarrow {t>110^{o}C}}Na_{2}SO_{4}+2HCl\uparrow }}}
С раствором нитрата серебра образует белый осадок хлорида серебра (качественная реакция на хлорид-ион):
- NaCl+AgNO3→NaNO3+AgCl↓{\displaystyle {\mathsf {NaCl+AgNO_{3}\rightarrow NaNO_{3}+AgCl\downarrow }}}
При смешивании с сульфатом меди в растворе получается тетрахлоркупрат натрия, при этом синий раствор зеленеет из-за преобладания гидратированного иона [CuCl4(h3O)2]2−{\displaystyle {\ce {[CuCl4(h3O)2]^2-}}}[22] :
- CuSO4+4NaCl⇄Na2[CuCl4]+Na2SO4{\displaystyle {\mathsf {CuSO_{4}+4NaCl\rightleftarrows Na_{2}[CuCl_{4}]+Na_{2}SO_{4}}}}
Учитывая огромные природные запасы хлорида натрия, необходимости в его промышленном или лабораторном синтезе нет. Однако, его можно получить различными химическими методами как основной или побочный продукт.
- получение из простых веществ натрия и хлора является экзотермической реакцией[23]:
- 2Na+Cl2→2NaCl+410 kJ/mol{\displaystyle {\mathsf {2Na+Cl_{2}\rightarrow 2NaCl+410\ kJ/mol}}}
- нейтрализация щелочи гидроксида натрия соляной кислотой[24]:
- NaOH+HCl→NaCl+h3O{\displaystyle {\mathsf {NaOH+HCl\rightarrow NaCl+H_{2}O}}}
Поскольку хлорид натрия в водном растворе почти полностью диссоциирован на ионы:
- NaCl→Na++Cl−{\displaystyle {\mathsf {NaCl\rightarrow Na^{+}+Cl^{-}}}}
Его химические свойства в водном растворе определяются соответствующими химическими свойствами катионов натрия и хлорид-анионов.
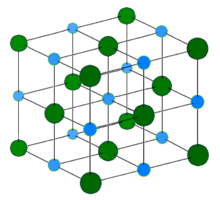 Кристаллическая решётка хлорида натрия.
Кристаллическая решётка хлорида натрия. Голубой цвет = Na+
Зелёный цвет = Cl−
Хлорид натрия образует бесцветные кристаллы кубической сингонии, пространственная группа Fm3m, параметры ячейки a = 0,563874 нм, d = 2,17 г/см3. Каждый из ионов Cl− окружён шестью ионами Na+ в октаэдрической конфигурации, и наоборот. Если мысленно отбросить, например, ионы Na+, то останется плотно упакованная кубическая структура ионов Cl−, называемая гранецентрированной кубической решёткой. Ионы Na+ тоже образуют плотно упакованную кубическую решётку. Таким образом, кристалл состоит из двух подрешёток, сдвинутых друг относительно друга на полупериод. Такая же решётка характерна для многих других минералов.
В кристаллической решётке между атомами преобладает ионная химическая связь, что является следствием действия электростатического взаимодействия противоположных по заряду ионов.
Об английской соли
Примерно 80 процентов людей обладают признаками недостатка магния в организме, и многие даже не догадываются об этом. А вы знали, чтобы ногти были крепкими, а зубы здоровыми, нужен не только кальций? Главное – это баланс кальция и магния в организме!
Магний – не по праву забытый и очень важный химический минерал, недостаток которого ведет к бессоннице, депрессии, атеросклерозу и болезням сердца. Большое количество людей не получают достаточное количество магния из пищи, что сказывается на здоровье.
Магний – это самый часто встречающийся минерал в нашем теле. Согласитесь, неправильно будет не считать его важным. Магний необходим для правильного функционирования каждой клеточки нашего организма, он также регулирует обмен веществ, важнейшие биохимические реакции и электролитный баланс. Магний активирует мышцы и нервы, помогает человеку синтезировать энергию, улучшает пищеварение. Чудодейственный элемент участвует в синтезе гормона серотонина, ответственного за наше настроение. А хорошее настроение человека – это залог успешного дня и жизни в целом!
Про дефицит магния в организме очень интересно рассказывает доктор Джастин Файнстайн, директор LIBR Float Clinic and Research Center: «Дефицит магния вносит свой вклад в высокий уровень умственных расстройств, кардио заболеваний, артрита и артроза. Повышая уровень магния в организме, вы можете избежать многих неприятностей со своим здоровьем».
Магний необходим для активности более чем 300 ферментов в нашем организме. Как биоэлемент, он нужен для поддержания метаболических функций организма. А также для профилактики ожирения. Добавление пищи, богатой этим элементом в свой рацион, приводит к улучшению чувствительности к инсулину, снижает гипергликемию, что снижает риск метаболического синдрома (компонентом которого и является ожирение). Его нехватка может приводить к многочисленным неприятным состояниям и недугам: высокому давлению, проблемам с сердцем, хроническому воспалению, артриту и артрозу, дерматиту, астме, расстройствам нервной системы, частым ОРЗ и ОРВИ, депрессии, бессоннице, судорогам и даже к паническим атакам и множеству других. Например, когда человек находится в состоянии стресса, потребность в магнии выше в несколько раз стандартной нормы!
И так, что же провоцирует недостаток магния? Самый главный враг – это стресс! Далее все просто: сахар, алкоголь, кофе, черный чай, соевые продукты и многие лекарственные препараты. Согласитесь, не так-то и трудно отказаться от этих продуктов питания?
А теперь проверьте, страдаете ли вы от:
· головных болей;
мигрени;
чувства слабости и усталости;
судорог;
аритмии;
страсти к шоколаду;
бессонницы или проблем со сном;
раздражительности;
беспокойства;
депрессии;
аллергии;
неприятного запаха тела;
запоров;
кариеса;
камней в почках?
Если человека беспокоят такие симптомы, то, скорее всего, у него явные признаки недостатка магния. Мы вам советуем незамедлительно обратиться к врачу.
На 99 процентов из сульфата магния высочайшего качества состоит английская соль. Она же Эпсома, или магнезия, или epsom salt – это натуральное минеральное вещество природного происхождения, соответствующее требованиям ГОСТ РФ.
Соль Эпсома родом из Англии. Добывают ее из горьких минеральных источников. Она отличается от традиционной соли тем, что представляет собой минеральное соединение магния и сульфата. Ее химическая формула MgSO4 показывает, что соль фактически можно разложить на магний, серу и кислород. Английская соль внешне похожа на поваренную соль и состоит из небольших бесцветных кристаллов.
Магний и сульфат легко впитываются через кожу, благодаря чему горячая ванна с солью Эпсома – отличный способ пополнить организм столь необходимым магнием. Человек, принимающий на регулярной основе ванны с английской солью, ощущает внутреннее энергетическое восстановление магнитного равновесия. Он испытывает физическую и эмоциональную легкость за счет магнезии, входящей в состав, которая в свою очередь рассеивает давление в теле. Основная ценность ее состоит в наружном применении, благодаря способности вытягивать токсины из тканей через кожу. Именно с этой целью врачи по настоящее время прописывают больным магниевые ванны.Уникальный состав английской соли позволяет назвать ее настоящим сокровищем для красоты. После принятия ванны с магниевой солью кожа преображается, увлажняется, источает здоровье, волосы становятся мягкими и шелковистыми, а самое главное преимущество таких ванн для женщин – это похудение. Секрет кроется в ее способности выводить лишнюю жидкость и шлаки из организма.
Спортсмены обычно используют магнезию против боли в мышцах, прибегая к процедуре флоатинга. Боль и забитость мышц уходят, так как выводится молочная кислота.
Эта соль является натуральным эксфолиантом и противовоспалительным средством, которое используют для лечения мышечной боли, сухой кожи и против различных заболеваний, как мы только что с вами увидели.
Будьте здоровы и не забывайте про магний!
Что такое соль? Формула, свойства соли (химия) :: SYL.ru
Для того чтобы ответить на вопрос, что такое соль, обычно долго задумываться не приходится. Это химическое соединение в повседневной жизни встречается достаточно часто. Об обычной поваренной соли и говорить не приходится. Подробное внутреннее строение солей и их соединений изучает неорганическая химия.
Определение соли
Четкий ответ на вопрос, что такое соль, можно найти в трудах М. В. Ломоносова. Такое имя он присвоил хрупким телам, которые могут растворяться в воде и не воспламеняются под воздействием высоких температур или открытого огня. Позднее определение выводили не из их физических, а из химических свойств данных веществ.

Школьные учебники неорганической химии дают достаточно ясное понятие того, что такое соль. Так называются продукты замещения химической реакции, при которой атомы водорода кислоты в соединении замещаются на металл. Примеры типичных соединений солей: NaCL, MgSO4. Легко увидеть, что любую эту запись можно разделить на две половины: в левой составляющей формулы всегда будет записан металл, а в правой – кислотный остаток. Стандартная формула соли выглядит следующим образом:
MenmКислотный остатокmn.
Физические свойства соли
Химия, как точная наука, вкладывает в название того или иного вещества всю возможную информацию о его составе и возможностях. Так, все наименования солей в современной интерпретации состоят из двух слов: одна часть имеет название металлического составляющего в именительном падеже, вторая — содержит описание кислотного остатка.
Эти соединения не имеют молекулярного строения, поэтому при обычных условиях они представляют собой твердые кристаллические вещества. Многие соли обладают кристаллической решеткой. Кристаллы этих веществ тугоплавки, поэтому для их плавления нужны очень высокие температуры. Например, сульфид бария плавится при температуре около 2200о С.

По растворимости соли делятся на растворимые, малорастворимые и нерастворимые. Примером первых могут служить хлорид натрия, нитрат калия. К малорастворимым относят сульфит магния, хлорид свинца. Нерастворимые – это карбонат кальция. Информация о растворимости того или иного вещества содержится в справочной литературе.
Рассматриваемый продукт химической реакции обычно не имеет запаха и обладает разным вкусом. Предположение о том, что все соли соленые — ошибочно. Чистый соленый вкус имеет только один элемент этого класса – наша старая знакома поваренная соль. Существуют сладкие соли бериллия, горькие – магния и безвкусные – например, карбонат кальция (мел обыкновенный).
Большинство данных веществ бесцветно, но среди них имеются и такие, которые имеют характерные окрасы. Например, железа (II) сульфат отличается характерным зеленым цветом, калия перманганат – фиолетовый, а кристаллы хромата калия – ярко-желтые.

Классификация соли
Химия разделяет все виды неорганических солей на несколько основных признаков. Соли, получающиеся при полном замещении водорода в кислоте, называют нормальными или средними. Например, сульфат кальция.
Соль, которая является производной от реакции неполного замещения, называется кислой или основной. Примером такого образования может быть реакция гидросульфата калия:
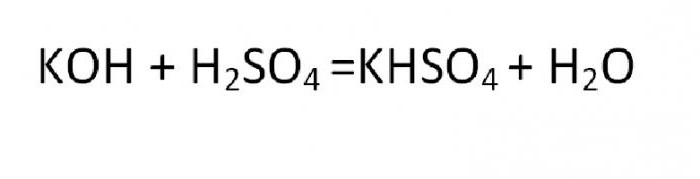
Основная соль получается при такой реакции, в которой гидроксогруппа не полностью замещается на кислотный остаток. Вещества данного вида могут быть образованны теми металлами, чья валентность равна двум или больше. Типичная формула соли этой группы может быть выведена из такой реакции:
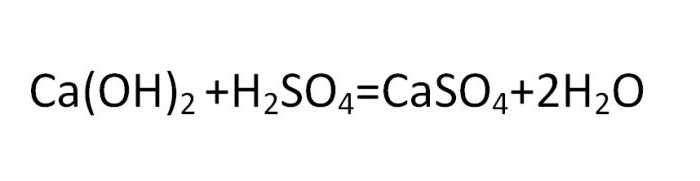
Нормальные, средние и кислые химические соединения образуют классы солей и являются стандартной классификацией этих соединений.
Двойная и смешанная соль
Химия неорганических веществ показывает, что данный продукт может быть образован двумя металлами и одной кислотой. В этом случае кислота должна иметь основность больше или равной 2. Такое соединение называют двойная соль. Химические соли этой группы – алюмокалиевые квасцы, их еще называют сульфат калия-алюминия.
Примером смешанной является кальциевая соль соляной и хлорноватистой кислоты: CaOCl2.
Номенклатура
Соли, образованные металлами с переменной валентностью, имеют дополнительное обозначение: после формулы в скобках пишут римскими цифрами валентность. Так, существует сульфат железа FeSO4 (II) и Fe2 (SO4)3 (III). В названии солей имеется приставка гидро-, если в ее составе существуют незамещенные атомы водорода. Например, гидрофосфат калия обладает формулой K2HPO4 .
Свойства солей в электролитах
Теория электролитической диссоциации дает собственное толкование химическим свойствам. В свете этой теории соль может быть определена как слабый электролит, который в растворенном виде диссоциирует (распадается) в воде. Таким образом, раствор соли можно представить как комплекс положительных отрицательных ионов, причем первые – это не атомы водорода Н+, а вторые – не атомы гидроксогруппы ОН—. Ионов, которые присутствовали бы во всех видах растворов солей, не существует, поэтому какими-либо общими свойствами они не обладают. Чем меньше заряды ионов, образующих раствор соли, тем лучше они диссоциируют, тем лучше электропроводимость такой жидкой смеси.
Растворы кислых солей
Кислые соли в растворе распадаются на сложные отрицательные ионы, представляющие собой кислотный остаток, и простые анионы, являющиеся положительно заряженными частицами металла.
 Например, реакция растворения гидрокарбоната натрия ведет к распаду соли на ионы натрия и остаток НСО3—.
Например, реакция растворения гидрокарбоната натрия ведет к распаду соли на ионы натрия и остаток НСО3—.Полная формула выглядит таким образом: NaHCO3 = Na+ + HCO3—,HCO3 — = H+ + CO32-.
Растворы основных солей
Диссоциация основных солей ведет к образованию анионов кислоты и сложных катионов, состоящих из металлов и гидроксокрупп. Эти сложные катионы, в свою очередь, также способны распадаться в процессе диссоциации. Поэтому в любом растворе соли основной группы присутствуют ионы ОН— . Например, диссоциация хлорида гидроксомагния протекает следующим образом:
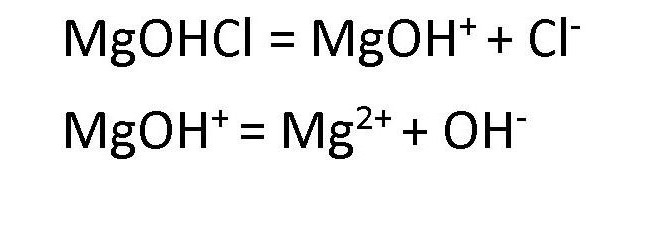
Распространение солей
Что такое соль? Этот элемент является одним из самых распространенных химических соединений. Всем известны поваренная соль, мел (карбонат кальция) и прочее. Среди солей карбонатной кислоты самым распространенным является карбонат кальция. Он является составной частью мрамора, известняка, доломита. А еще карбонат кальция — основа для формирования жемчуга и кораллов. Это химическое соединение является неотъемлемой составляющей для формирования твердых покровов у насекомых и скелетов у хордовых животных.
Поваренная соль известна нам с детства. Врачи предостерегают от ее чрезмерного употребления, но в умеренных количествах она крайне необходима для осуществления жизненных процессов в организме. А нужна она для поддержания правильного состава крови и вырабатывания желудочного сока. Физрастворы, неотъемлемая часть инъекций и капельниц, есть не что иное, как раствор поваренной соли.
Соли: классификация и химические свойства
Солями называются сложные вещества, молекулы которых, состоят из атомов металлов и кислотных остатков (иногда могут содержать водород). Например, NaCl – хлорид натрия, СаSO4 – сульфат кальция и т. д.
 Практически все соли являются ионными соединениями, поэтому в солях между собой связаны ионы кислотных остатков и ионы металла:
Практически все соли являются ионными соединениями, поэтому в солях между собой связаны ионы кислотных остатков и ионы металла:
Na+Cl– – хлорид натрия
Ca2+SO42– – сульфат кальция и т.д.
Соль является продуктом частичного или полного замещения металлом атомов водорода кислоты. Отсюда различают следующие виды солей:
1. Средние соли – все атомы водорода в кислоте замещены металлом: Na2CO3, KNO3 и т.д.
2. Кислые соли – не все атомы водорода в кислоте замещены металлом. Разумеется, кислые соли могут образовывать только двух- или многоосновные кислоты. Одноосновные кислоты кислых солей давать не могут: NaHCO3, NaH2PO4 ит. д.
3. Двойные соли – атомы водорода двух- или многоосновной кислоты замещены не одним металлом, а двумя различными: NaKCO3, KAl(SO4)2 и т.д.
4. Соли основные можно рассматривать как продукты неполного, или частичного, замещения гидроксильных групп оснований кислотными остатками: Аl(OH)SO4 , Zn(OH)Cl и т.д.
По международной номенклатуре название соли каждой кислоты происходит от латинского названия элемента. Например, соли серной кислоты называются сульфатами: СаSO4 – сульфат кальция, Mg SO4 – сульфат магния и т.д.; соли соляной кислоты называются хлоридами: NaCl – хлорид натрия, ZnCI2 – хлорид цинка и т.д.
В название солей двухосновных кислот добавляют частицу «би» или «гидро»: Mg(HCl3)2 – бикарбонат или гидрокарбонат магния.
При условии, что в трехосновной кислоте замещён на металл только один атом водорода, то добавляют приставку «дигидро»: NaH2PO4 – дигидрофосфат натрия.
Соли – это твёрдые вещества, обладающие самой различной растворимостью в воде.
 Химические свойства солей
Химические свойства солей
Химические свойства солей определяются свойствами катионов и анионов, которые входят в их состав.
1. Некоторые соли разлагаются при прокаливании:
CaCO3 = CaO + CO2↑
2. Взаимодействуют с кислотами с образованием новой соли и новой кислоты. Для осуществление этой реакции необходимо, чтобы кислота была более сильная чем соль, на которую воздействует кислота:
2NaCl + H2 SO4 → Na2SO4 + 2HCl↑.
3. Взаимодействуют с основаниями, образуя новую соль и новое основание:
Ba(OH)2 + Mg SO4 → BaSO4↓ + Mg(OH)2.
4. Взаимодействуют друг с другом с образованием новых солей:
NaCl + AgNO3 → AgCl + NaNO3 .
5. Взаимодействуют с металлами, которые стоят в раду активности до металла, который входит в состав соли:
Fe + CuSO4 → FeSO4 + Cu↓.
Остались вопросы? Хотите знать больше о солях?
Чтобы получить помощь репетитора – зарегистрируйтесь.
Первый урок – бесплатно!
Зарегистрироваться
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.




