8. Автоклав
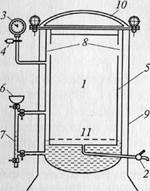
Автоклав – аппарат для стерилизации и обеззараживания медицинских инструментов, принадлежностей, материалов под воздействием горячего водяного пара( текучим или паром под давлением). Автоклав представляет собой котел с двойными стенками, между которыми находится водопаровая камера. В нее через воронку вливают воду. Образующийся пар проходит в стерилизационную камеру, где расположен стерилизуемый материал. Обязательно наличие термометра и манометра.
Виды :стационарные и переносные, горизонтальные и вертикальные, с одно и двусторонней загрузкой, круглые и квадратные, общего и специального назначения, электрические, огневые, электроогневые
Упакованные предметы укладывают в камеру. Стерилизуют при 2 атм в течение 20 мин (t132), при 1,1 атм 45 мин (t120)
Выделяют 4 стадии стерилизации : нагревания, уравновешивания, уничтожения, время охлаждения.
Контроль стерильности: физический ( основан на достижении точки плавления – в автоклав ставят пробирку с веществом, которое должно расплавится), бактериологический посев, исследование температуры при стерилизации (термометр) ,использование стеритестов.
При этом способе стерилизации действующим агентом служит горячий пар. Стерилизацию просто текучим паром в настоящее время не используют, так как температура пара в обычных условиях (100 ?С) не достаточна для уничтожения всех микробов.
В автоклаве (аппарат для стерилизации паром под давлением) возможно нагревание воды при повышенном давлении (рис. 2-4). Это повышает точку кипения воды и соответственно температуру пара до 132,9 ?С (при давлении 2 атм).
Хирургические инструменты, перевязочный материал, бельё и другие материалы загружают в автоклав в специальных металлических коробках — биксах Шиммельбуша (рис. 2-5). Биксы имеют боковые отверстия, которые перед стерилизацией открывают. Крышку бикса плотно закрывают.
После загрузки биксов автоклав закрывают герметичной крышкой и проводят необходимые манипуляции для начала его ра- боты в определённом режиме.
Работу автоклава контролируют при помощи показателей манометра и термометра. Существует три режима стерилизации:
• при давлении 1,1 атм (t = 119,6 ?С) — 1 ч;
• при давлении 1,5 атм (t = 126,8 ?С) — 45 мин;
• при давлении 2 атм (t = 132,9 ?С) — 30 мин.
По окончании стерилизации биксы некоторое время остаются в горячем автоклаве для просушки при немного приоткрытой дверце. При извлечении биксов из автоклава закрывают отверстия в стенках биксов и отмечают дату стерилизации (обычно на прикреплённом к биксу кусочке клеёнки). Закрытый бикс сохраняет стерильность находящихся в нём предметов в течение 72 ч.
Рис. 2-4. Автоклав (схема). Аи Б — наружная и внутренняя стенки автоклава; 1 — термометр; 2 — водомерное стекло; 3 — впускной кран; 4 — выпускной кран; 5 — манометр; 6 — предохранительный клапан
9. Виды и принципы укладок материала в биксы для стерилизации. Виды стерилизации
Перевязочный материал и бельё стерилизуют автоклавированием при стандартных режимах. Перед стерилизацией перевязочный материал и бельё укладывают в биксы. Существует три основных вида укладки бикса: универсальная, целенаправленная и видовая укладки.
1-Универсальная укладка. Обычно используют при работе в перевязочной и при малых операциях. Бикс условно разделяют на секторы, каждый из них заполняют определённым видом перевязочного материала или белья: в один сектор помещают салфетки, в другой — шарики, в третий — тампоны и т.д.
2-Целенаправленная укладка. Предназначена для выполнения типичных манипуляций, процедур и малых операций. Например, укладка для трахеостомии, катетеризации подключичной вены, перидуральной анестезии и пр. В бикс укладывают все инструменты, перевязочный материал и бельё, необходимые для осуществления процедуры.
3-Видовая укладка. Обычно используют в операционных, где необходимо большое количество стерильного материала. При этом в один бикс, например, укладывают хирургические халаты, в другой — простыни, в третий — салфетки и т.д.
В небольшом количестве используют перевязочный материал в упаковках, прошедший лучевую стерилизацию. Существуют и специальные наборы операционного белья одноразового использования (халаты и простыни), изготовленного из синтетических тканей, также подвергшихся лучевой стерилизации.
Вначале проверяют исправность бикса, затем на его дно помещают развёрнутую простыню, концы которой находятся снаружи. Перевязочный материал укладывают вертикально по секторам пачками или пакетами. Материал укладывают неплотно, чтобы обеспечить доступ пара, внутрь помещают индикаторы режима стерилизации (максимальные термометры, плавящиеся вещества или пробирки с тест-микробом), края простыни заворачивают, бикс закрывают крышкой и защёлкивают замок. К крышке бикса прикрепляют бирку из клеёнки с указанием даты стерилизации и фамилии осуществлявшего её.
Существуют 3 основных режима стерилизации: 1) при давлении 1,1 атм – 1 час; 2) при давлении 1,5 атм – 45 мин; 3) при давлении 2 атм – 30 мин.

ТОП 10: |
В микробиологической практике стерилизацию в автоклавах осуществляют при температуре 111 — 138 °С, т.е. от 0,5 до 2,5 ати. Температура ниже 111 °С не может считаться надежной; температура выше 138°С, как правило, не является необходимой, к тому же чем выше давление пара, тем сложнее условия эксплуатации автоклава. При использовании автоклавов без вакуумных насосов наиболее надежными считают следующие режимы стерилизации: 15 — 45 мин при 121 °С (1 ати) и 10 — 30 мин при 128 °С (1,5 ати). Микробиологи чаще всего стерилизуют среды при 0,5 и 1 ати. Температура и длительность автоклавирования питательных сред определяются прежде всего их составом, термоустойчивостью или термолабильностью компонентов. Такие легко разрушающиеся субстраты, как молоко или желатиновые среды, а также субстраты, содержащие сахара, витамины (пивное сусло, соки, дрожжевой автолизат и др.), обычно стерилизуют при 0,5 ати в течение 15 — 30 мин. Мясопептонные среды можно стерилизовать при 1 ати 20 мин. Среды, содержащие агар, стерилизуются труднее, потому что стерилизация начинается фактически после того, как агар расплавится. Но и расплавленный агар требует для стерилизации в два раза больше времени, чем тот же объем воды. С трудом поддаются стерилизации в автоклаве различные порошки (тальк, мел) и вязкие жидкости (глицерин, вазелиновое масло), поскольку они плохо передают тепло и очень медленно прогреваются. Их лучше стерилизовать в сушильных шкафах при 160 °С в течение 2 ч или 1 ч при 170 °С. Слой масла или порошка в сосуде не должен превышать 1,5 см. Имеются субстраты, в которых могут быть споры, отличающиеся особой термостабилъностью. К ним относится почва, причем она, кроме того, нагревается с замедленной скоростью. Ее обычно стерилизуют при 1 ати либо один раз 2 ч, либо два дня подряд по 1 ч, а иногда 2 ч при 2 ати. Выбирая режим стерилизации, необходимо учитывать рН среды. При кислой реакции многие вещества, входящие в ее состав, могут подвергнуться гидролизу. Чем ниже значение рН, чем выше температура и продолжительнее время стерилизации, тем интенсивнее происходит гидролиз. В результате после стерилизации перестают застывать среды с желатиной и даже с агаром. Если реакция среды щелочная, то при стерилизации выпадают в осадок соли железа; они карамелизуются и сахара становятся непригодными для использования бактериями. В некоторых случаях в процессе стерилизации изменяется рН среды. Так, если рН среды с углеводами выше 7,0, то может произойти ее подкисление до рН 6,0. Чтобы избежать таких явлений, рекомендуется углеводы, фосфаты, соли железа автоклавировать отдельно в виде более или менее концентрированных растворов в дистиллированной воде при том значении рН, которое обеспечивает целостность вещества. После стерилизации растворы объединяют в нужном соотношении. Таким приемом раздельной стерилизации в микробиологии пользуются довольно часто, поскольку многие компоненты сред нельзя стерилизовать одним и тем же способом. Режим автоклавирования в значительной степени зависит от объема стерилизуемого субстрата. Чем больше объем, тем больше времени при одной и той же температуре (давлении) требуется для обеспечения надежности стерилизации. Имеет значение толщина стенок и форма емкостей (табл. 4.2). Это нужно учитывать в практической работе. Например, не следует стерилизовать термочувствительный субстрат одновременно в пробирках и больших бутылях. Если среда стерилизуется по режимам, рекомендуемым для малых объемов, содержимое бутыли может не про-стерилизоваться. Если же стерилизация проводится с расчетом на большой объем, среда в пробирке прогревается намного дольше и может испортиться. После автоклавирования среды для проверки стерильности выдерживают — 3 сут в термостате при 30 °С. Если в средах обнаруживается рост микроорганизмов, их готовят заново. |
Микробиология — Стр 2
11
Когда необходимо провести рассев микроорганизмов из жидкой питательной среды на поверхность плотной среды в чашке Петри, поступают следующим образом. Расплавленную на кипящей водяной бане стерильную питательную среду, содержащую агар или желатину, разливают в стерильные чашки Петри. Для этого сосуд со средой берут в правую руку, вынимают из него пробку, зажимая ее мизинцем и безымянным пальцем левой руки, обжигают горло сосуда в пламени горелки и, приоткрыв большим и средним пальцами левой руки крышку чашки Петри, быстро наливают в чашку расплавленную среду в таком количестве(20-30 мл), чтобы дно чашки было полностью покрыто. Крышку тотчас закрывают и чашку оставляют на горизонтальной поверхности до тех пор, пока не застынет среда. Для посева приоткрывают крышку чашки Петри и на поверхность плотной среды наносят каплю или «петлю» жидкой культуры, которую осторожно распре-
деляют стеклянным стерильным шпателем (шпатель Дригальского) либо петлей.
Все описанные манипуляции следует проводить около пламени горелки, но не в пламени, по возможности быстро, чтобы не загрязнить культуру посторонними микроорганизмами. Не рекомендуется делать резкие движения и ходить около работающего с чистой культурой, так как движение воздуха увеличивает вероятность случайного ее загрязнения. После пересевов пробирки или другие сосуды, в которых выращивают микроорганизмы, помещают в термостаты, где с помощью терморегуляторов поддерживается постоянная температура.
Посуду с культурами микроорганизмов, подлежащими выбрасыванию, следует автоклавировать, чтобы убить клетки, и только после этого мыть. Культуры на плотных питательных средах можно заливать на сутки дезинфицирующим раствором, после чего их выбрасывают и посуду моют. Неаккуратное обращение с культурами микроорганизмов приводит к возникновению бактериального аэрозоля.
3. Ведение лабораторных записей
Журнал лабораторных работ является документом, позволяющим контролировать правильность полученных результатов. В нем должны быть записаны сведения, имеющие отношение к выполнению данной работы. Запись необходимо вести четко, аккуратно и в определенном порядке, например:
1.Название опыта и его цель, дата постановки и окончания.
2.Объект исследования.
3.Условия проведения опыта.
4.Основной принцип используемого метода анализа.
5.Полученные результаты.
Цифровой материал приводят в таблицах. Если необходимо, делают графики, диаграммы, рисунки. Каждая лабораторная работа должна заканчиваться собственными наблюдениями и выводами, записанными в журнале. Журнал является собственностью лаборатории, в которой проводилась работа, и всегда хранится в лаборатории.
12
Лабораторная работа № 1.2.
Методы стерилизации
Стерилизация является одним из важнейших и необходимых приемов в микробиологической практике. Слово «стерилизация» в переводе с латинского означает «обеспложивание». В практической работе под стерилизацией понимают методы, применяемые для уничтожения всех форм жизни как на поверхности, так и внутри стерилизуемых объектов. Микробиологи стерилизуют питательные среды, посуду, различные инструменты и другие необходимые предметы с целью не допустить развитие посторонних микроорганизмов в исследуемых культурах. Термин «стерильность» имеет абсолютное значение. Можно говорить только либо о стерильности, либо о нестерильности, но не может быть состояния«частичной или неполной стерильности», «близкого к стерильному», «почти стерильного».
Различают термическую и холодную стерилизацию. В микробиологии находят применение следующие способы термической стерилизации: прокаливание в пламени и обжигание, сухожаровая стерилизация (горячим воздухом), стерилизация насыщенным паром под давлением (автоклавирование), дробная стерилизация (тиндализация), кипячение. Из методов холодной стерилизации микробиологи используют стерилизацию фильтрованием, газообразными средствами, ультрафиолетовыми лучами и другими видами излучений.
Возможность и целесообразность применения того или иного способа определяются в первую очередь физико-химическими свойствами материала, подлежащего стерилизации, а иногда и целью исследования.
1. Стерилизация питательных сред Стерилизация насыщенным паром под давлениемавтоклавирова-
ние. Данный способ стерилизации питательных сред является наиболее надежным и чаще всего применяемым. Он основан на нагревании материала насыщенным водяным паром при давлении выше атмосферного. Известно, что температура пара возрастает при повышении его давления (табл. 1).
Совместное действие высокой температуры и пара обеспечивает особую эффективность этого процесса. При этом погибают и вегетативные клетки, и споры микроорганизмов. Установлено, что споры большинства микроорганизмов не выдерживают и 5-минутную экспозицию в насыщенном паре при121°С. Лишь споры некоторых почвенных бактерий погибают при 1 ати только через 30 мин.
Таблица 1 — Температура насыщенного пара при разных давлениях
| Давление |
| Температура, °С | |
атм | ати | кПа | ||
| ||||
1,0 | 0,0 | 101,32 | 100 | |
1,5 | 0,5 | 151,98 | 111 | |
2,0 | 1,0 | 202,65 | 121 | |
2,5 | 1,5 | 251,20 | 128 | |
3,0 | 2,0 | 299,75 | 134 |
13
Стерилизацию паром под давлением осуществляют в специальных герметически закрывающихся толстостенных аппаратах- автоклавах. Автоклавы разнообразны по форме, размерам, рабочему давлению, конструкции и другим показателям. Они могут быть с ручным управлением, полуавтоматические и автоматические, но, поскольку все автоклавы предназначены для выполнения одной и той же задачи — стерилизации, основной принцип их устройства один и тот же.
На рис. 1 показана схема вертикального автоклава с ручным управлением.
Автоклав представляет собой металлический двустенный резервуар, способный выдержать высокое давление. Его внутренняя часть является стерилизационной камерой (7). В нее помещают стерилизуемый материал. Стерилизационная камера снабжена краном (2) для выхода воздуха, манометром (3) для определения давления пара и предохранительным клапаном(4) для выхода пара при повышении давления сверх необходимого и для предотвращения разрыва автоклава. Пространство между стенками, называемое водопаровой камерой (5), заполняется через воронку (6) водой (лучше дистиллированной, чтобы не образовывалась накипь) до определенного уровня, который отмечен на специальной водомерной трубке автоклава (7). Выше этого уровня воду наливать не следует, так как при бурном кипении вода может попасть в трубку, ведущую к манометру и исказить его показания. В верхней части внутренней стенки водопаровой камеры имеются отверстия (8), через которые пар поступает в стерилизационную камеру. Паровой котел сверху покрыт защитным кожухом (9). Он предохраняет котел от механических повреждений, а работающего около автоклаваот ожогов. Для создания герметичности автоклав плотно закрывают массивной крышкой(10) с резиновой прокладкой. Стерилизуемые предметы помещают на специальную подставку (11).
Процесс автоклавирования. Отдельные операции процесса стерилизации в автоклавах разных типов могут быть несколько различными. Соответственно несколько различается и техника работы с ними, однако общий принцип проведения стерилизации в разных автоклавах одинаковый.
Перед работой осматривают автоклав и контрольно-измерительную аппаратуру. При наличии любой неисправности (смещение стрелки манометра с нуля, трещина на водомерной трубке и др.) работать с прибором нельзя. После осмотра автоклава в водопаровую камеру наливают воду до верхней отметки на водомер-
14
ной трубке. В стерилизационную камеру на специальную подставку из дерева помещают стерилизуемый материал. Предметы следует размещать не слишком плотно, так как пар должен свободно проходить между ними, иначе они не нагреются до нужной температуры и могут остаться нестерильными. Загрузив стерилизационную камеру, устанавливают и плотно завинчивают крышку (дверь) автоклава. Затем открывают кран, соединяющий стерилизационную камеру с наружным воздухом, и включают нагрев. После начала парообразования удаляют воздух из стерилизационной камеры. Это необходимое условие стерилизации, так как при одном и том же давлении температура чистого пара выше температуры смеси пара и воздуха. Если в автоклаве останется воздух, материал может не простерилизоваться. Наиболее простой и очень распространенный способ освобождения автоклава от воздуха — вытеснение воздуха паром. Пар и конденсат отводят либо в сосуд с водой, либо в специальное устройство, соединенное с канализацией. В первом случае на кран(2) надевают резиновый шланг, который опускают в воду. Началом продувания считается появление устойчивой непрерывной струи чистого пара. Пока в автоклаве еще имеется воздух, смесь воздуха и пара, проходя через воду, издает сильный треск. Чистый пар выходит с равномерным шипящим звуком. Его пропускают в течение 10 мин. В целом вся операция с момента появления пара с воздухом должна занимать не более 15-20 мин, иначе в автоклаве останется мало воды и он может испортиться. Чтобы уменьшить расход пара (воды), кран открывают не полностью. Степень открывания крана устанавливают на практике при эксплуатации автоклава. В наиболее совершенных автоклавах воздух из стерилизационной камеры удаляют с помощью вакуумного насоса.
Когда воздух вытеснен, закрывают пароотводной кран, и давление пара доводят до показания, соответствующего режиму стерилизации. Режим автоклавирования часто выражают в единицах избыточного давления, указывая при этом длительность его поддержания, например стерилизация при1 ати в течение20 мин. На манометре автоклава обозначается именно то избыточное давление, которое создается в автоклаве сверх нормального. Нередко режим автоклавирования характеризуется температурой и временем. Как только стрелка манометра дойдет до указателя определенного дополнительного давления ,иследовательно, температура пара достигнет соответствующего значения, этот уровень давления пара поддерживают в течение необходимого времени путем ручного или автоматического регулирования подачи пара. В автоматических автоклавах подачу пара регулируют электроконтактным манометром.
По окончании времени стерилизации выключают нагрев автоклава. Давление в автоклаве постепенно падает и сравнивается с атмосферным. Лишь после этого открывают кран, выводящий пар. Преждевременное открывание крана недопустимо, так как перегретые среды при резком снижении давления сразу же бурно закипают, смачивают и даже иногда выталкивают ватные пробки, что нарушает стерильность материала. Когда пар выйдет, открывают крышку (дверь)
15
автоклава, соблюдая при этом осторожность во избежание ожога паром лица и рук. Удаление пара из стерилизационной камеры автоклавов, оснащенных вакуумным насосом, осуществляют с помощью насоса. Одновременно происходит подсушивание стерильного материала.
Поскольку автоклав работает при высоких давлениях и температурах, неправильное обращение с ним может быть причиной несчастных случаев. Установка автоклава и работа с ним производятся при точном и строгом выполнении правил, указанных в прилагаемой к автоклаву инструкции. К работе допускаются только подготовленные лица, имеющие специальное разрешение.
При необходимости проконтролировать температуру в автоклаве пользуются разными веществами, плавящимися при определенной температуре. Эти вещества предварительно смешивают с нейтральными красителями и помещают в автоклав до начала стерилизации. В качестве индикаторов температуры используют фенантрен (температура плавления 98-100°С), бензаурин (115°С), серу (119°С), бензойную кислоту (121-122°С), мочевину (132°С), глюкозу (146°С), тиомочевину (180°С), аскорбиновую кислоту (187-192°С). На 100 г этих веществ берут 0,01 г красителя (фуксин, метиленовый синий), тщательно смешивают, рассыпают в стеклянные трубочки с одинаковым диаметром и толщиной стенок, запаивают и в вертикальном положении раскладывают между стерилизуемым материалом в автоклаве. По достижении в сосуде соответствующей температуры эти вещества расплавляются и окрашиваются в цвет добавленного в них красителя.
Подготовка сред к стерилизации. При автоклавировании 3 — 5% жидко-
сти теряется в результате испарения, поэтому рекомендуется в приготавливаемые среды добавлять сверх объема примерно 5% дистиллированной воды. Тогда после стерилизации среда (раствор) будет иметь требуемую концентрацию.
Среды обычно стерилизуют в пробирках, колбах, бутылях. Емкости заполняют средой не более чем на половину их высоты, чтобы предотвратить смачивание пробок. Сосуды со средами закрывают ватными пробками. Они предохраняют среду от заражения микроорганизмами, находящимися в окружающем воздухе.
Пробки должны быть достаточно плотными, чтобы выполнять эту функцию, но с достаточно равномерным распределением волокон ваты, так как через них происходит газообмен культур с окружающей средой. Слишком плотные пробки затрудняют снабжение культур воздухом.
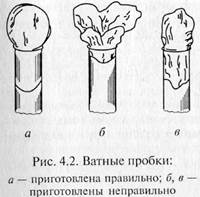
Для приготовления пробки плоский кусок ваты, взятый вдоль волокна, скатывают валиком. Чтобы придать пробке прочность, ее прокатывают между ладонью и чистым стеклом, лежащим на столе. Длина пробки для обычной пробирки примерно 4см. Пробка должна входить в пробирку на1,5 — 2,0 см (рис. 2). Для сохранения формы пробку вынимают из горлышка, слегка вращая. Удобно обернуть пробку чистой марлевой салфеткой.
16
Перед стерилизацией пробки можно прикрыть бумажными колпачками. Нельзя обертывать пробки сосудов, которые будут стерилизоваться в автоклаве, целлофаном, фольгой или другими материалами, не пропускающими пар, так как пар должен проникать через пробку в сосуд, иначе среды не нагреются до нужной температуры и не простерилизуются. При использовании стеклянных, резиновых, корковых и других пробок их завертывают в двойной слой оберточной бумаги и стерилизуют привязанными к склянке, закрытой ватной пробкой. Пробки в сосуде меняют стерильно около пламени горелки.
Выбор режима автоклавирования. В микробиологической практике стерилизацию в автоклавах осуществляют при температуре111-138°С, т. е. от 0,5 до 2,5 ати. Температура ниже 111°С не может считаться надежной; температура выше 138°С, как правило, не является необходимой, к тому же чем выше давление пара, тем сложнее условия эксплуатации автоклава. При использовании автокла-
вов без вакуумных насосов наиболее надежными считают следующие режимы стерилизации: 15 — 45 мин при 1210С (1 ати) и 10-30 мин при 1280С (1,5 ати). Микробиологи чаще всего стерилизуют среды при 0,5 и 1 ати. Температура и длительность автоклавирования питательных сред определяются прежде всего их составом, термоустойчивостью или термолабильностью компонентов. Такие легко разрушающиеся субстраты, как молоко или желатиновые среды, а также субстраты, содержащие сахара, витамины (пивное сусло, соки, дрожжевой автолизат и др.), обычно стерилизуют при0,5 ати в течение 15 — 30 мин. Мясопептонные среды можно стерилизовать при 1 ати 20 мин. Среды, содержащие агар, стерилизуются труднее, потому что стерилизация начинается фактически после того, как агар расплавится. Но и расплавленный агар требует для стерилизации в два раза больше времени, чем тот же объем воды. С трудом поддаются стерилизации в автоклаве различные порошки (тальк, мел) и вязкие жидкости (глицерин, вазелиновое масло), поскольку они плохо передают тепло и очень медленно прогреваются. Их лучше стерилизовать в сушильных шкафах при160°С в течение 2 ч или 1 ч при 1700С. Слой масла или порошка в сосуде не должен превышать 1,5 см.
Имеются субстраты, в которых могут быть споры, отличающиеся особой термостабильностью. К ним относится почва, причем она, кроме того, нагревается с замедленной скоростью. Ее обычно стерилизуют при1 ати либо один раз2 ч, либо два дня подряд по 1 ч, а иногда 2 ч при 2 ати.
17
Выбирая режим стерилизации, необходимо учитывать рН среды. При кислой реакции многие вещества, входящие в ее состав, могут подвергнуться гидролизу. Чем ниже значение рН, чем выше температура и продолжительнее время стерилизации, тем интенсивнее происходит гидролиз. В результате после стерилизации перестают застывать среды с желатиной и даже с агаром. Если реакция среды щелочная, то при стерилизации выпадают в осадок соли железа; они карамелизуются и сахара становятся непригодными для использования бактериями. В некоторых случаях в процессе стерилизации изменяется рН среды. Так, если рН среды с углеводами выше 7,0, то может произойти ее подкисление до рН 6,0. Чтобы избежать таких явлений, рекомендуется углеводы, фосфаты, соли железа авто-
клавировать отдельно в виде более или менее концентрированных растворов в дистиллированной воде при том значении рН, которое обеспечивает целостность вещества. После стерилизации растворы объединяют в нужном соотношении. Таким приемом раздельной стерилизации в микробиологии пользуются довольно часто, поскольку многие компоненты сред нельзя стерилизовать одним и тем же способом.
Режим автоклавирования в значительной степени зависит отобъема стерилизуемого субстрата. Чем больше объем, тем больше времени при одной и той же температуре (давлении) требуется для обеспечения надежности стерилизации. Имеет значение толщина стенок и форма емкостей (табл. 2). Это нужно учитывать в практической работе.
Например, не следует стерилизовать термочувствительный субстрат одновременно в пробирках и больших бутылях. Если среда стерилизуется по режимам, рекомендуемым для малых объемов, содержимое бутыли может не — про стерилизоваться. Если же стерилизация проводится с расчетом на большой объем, среда в пробирке прогревается намного дольше и может испортиться.
После автоклавирования среды для проверки стерильности выдерживают 2-3 сут. в термостате при 30°С. Если в средах обнаруживается рост микроорганизмов, их готовят заново.
Дробная стерилизация (тиндализация) и пастеризация. Тиндализация,
или дробная стерилизация, была предложена в 1877 г. Дж.Тиндалем. Она применяется для сред, портящихся при действии температур выше100°С. Тиндализацию осуществляют текучим паром в автоклаве с незавинченной крышкой или в кипятильнике Коха. Среды прогревают несколько раз по10-15 мин. Между прогреванием среды ставят в термостат при температуре 300С на 8-12 ч для прорастания жизнеспособных спор. Среды, не выдерживающие нагревания при1000С, прогревают более осторожно: при 60-80°С через каждые 8-12 ч 4-5 сут. подряд.
18
Таблица 2 — Зависимость продолжительности стерилизации жидкости от объема сосудов
Емкость | Объем | Время стерилизации при | ||
мм | мл | 121-123°С, мин | ||
| ||||
Пробирки | 18 х 150 |
| 12-14 | |
| 32 х 200 |
| 13-17 | |
| 38 x 200 |
| 14-20 | |
Колбы: |
| 50 | 12-14 | |
тонкостенные |
| 125 | 12-14 | |
|
| 200 | 12-15 | |
|
| 500 | 17-22 | |
|
| 900 | 19-24 | |
|
| 1000 | 20-25 | |
|
| 1800 | 25-30 | |
|
| 2000 | 30-35 | |
толстостенные |
| 500 | 24-28 | |
|
| 1000 | 25-30 | |
|
| 2000 | 40-45 | |
Матрасы |
| 1000 | 30-35 | |
Бутыли |
| 9000 | 50-55 | |
|
| 100 | 13-17 | |
|
|
|
| |
Однократный прогрев материала при температуре ниже1000С известен под названием пастеризация. Этот метод, предложенный Пастером, предназначен для уничтожения только бесспоровых форм микроорганизмов. Следовательно, в подавляющем большинстве случаев он не обеспечивает стерильности. Пастеризацию проводят при 60-800С в течение 10-30 мин. Пастеризацию используют в пищевой промышленности для обработки молока, фруктовых соков, вина, пива и др.
Стерилизация фильтрованием. Фильтрованием стерилизуют синтетические среды строго определенного состава, которые содержат легкоразрушающиеся или летучие компоненты — витамины, аминокислоты (цистеин и цистин), белки, ароматические углеводороды, антибиотики и др. Фильтрование жидкостей осуществляют через мелкопористые материалы, легко адсорбирующие клетки микроорганизмов: асбест, целлюлозу, фарфор, каолин и т.д.
Стерилизующими фильтрами теоретически считают такие, размер пор которых не превышает 0,7 мкм. В практике же пригодность фильтров для стерилизации устанавливают путем пробной фильтрации через них суспензии какогонибудь мелкого микроорганизма, например Serratia marcescens. Для проверки на стерильность фильтрат в большом количестве высевают на питательную среду. Если в течение 5 сут. тест-организм не вырастет, фильтры могут быть использованы для стерилизации. Широкое распространение получили мембранные фильтры. Это диски разного размера, диаметра, напоминающие бумажные. Их готовят на основе нитроцеллюлозы. Мембранные фильтры в зависимости от величины
19
пор применяют для фильтрования и стерилизации. Для стерилизации используют фильтры с номера 1 до номера 4 фирмы «Владипор» (Россия), фильтры с номера 5 до номера 10 фирмы «СИНПОР» (Чехия) и марок VF, VM, VC, SLGS, SLHA, DA фирмы «МИЛЛИПОР» (США).
Плотные диски, изготовленные из смеси асбеста с целлюлозой, называются фильтрами Зейтца. В зависимости от диаметра пор они обозначаются разными индексами: ЕК — поры диаметром 1,5-1,8 мкм; EKS — 1,2-1,5; EKS-1 — 1,0-1,2; ЕКР —
0,8-1,0 мкм. В России выпускают асбестовые фильтры марок Фи СФ. Стерили-
2
зующими являются СФ-3 и СФ-4.
Асбестовую пластинку помещают в специальный держатель, который обычно изготавливают из нержавеющей стали, и крепко зажимают винтами между верхней (цилиндрической) и нижней (воронкообразной) частями держателя. Трубка нижней части держателя через резиновую пробку проходит в колбу Бунзена. Нередко весь этот прибор в собранном виде называют фильтром Зейтца. Для стерилизации используют стеклянные пористые фильтры, а также изготовленные из каолина с примесью кварцевого песка- «свечи» Шамберлана и из инфузорной земли — «свечи» Беркефельда. Пористость первых обозначается буквойL с цифрами от 1 до 13 соответственно уменьшению диаметра пор фильтра от9 до 1,2 мкм. Мелкопористые «свечи» обозначаются маркой ,В крупнопористые — F. Фильтры Беркефельда обозначают буквамиV, N, W, что соответствует следующим размерам пор (мкм): 8-12, 5-7, 3-4.
«Свечи» и специальные держатели с закрепленными в них асбестовыми фильтрами герметически соединяют с колбой Бунзена для фильтрации в вакууме (рис. 3). Перед употреблением фильтры, их держатели и приемник фильтрата должны быть простерилизованы.
Мембранные фильтры стерилизуют автоклавированием при1 ати 15 мин или длительным кипячением. Держатель вместе с резиновой пробкой заворачи-
20
вают в бумагу и автоклавируют при 1 ати 20 — 30 мин. Фильтры Зейтца автоклавируют в собранном виде.
«Свечи» стерилизуют вместе с резиновыми пробками в автоклаве. Колбу Бунзена закрывают ватной пробкой, в отводную трубку вставляют тампон и стерилизуют горячим воздухом — сухим жаром.
2. Стерилизация стеклянной посуды
Основной способ стерилизации стеклянной посудыобработка сухим горячим воздухом при температуре не выше180°С в течение 1 — 3 ч (табл. 3). При этом погибают и вегетативные клетки, и споры микроорганизмов. Стерилизацию осуществляют в специальных суховоздушных(сухожаровых) стерилизаторах и сушильных шкафах, приспособленных для стерилизации. Они различаются по форме и способам обогрева, но имеют сходное устройство. Их делают из термостойких материалов — обычно из металла и асбеста. Внутри стерилизатора имеются полки для размещения посуды, а наверху — отверстие, в котором с помощью пробки укрепляют термометр. У стенки стерилизатора (шкафа) или вблизи греющей поверхности температура всегда значительно выше, чем внутри, поэтому ртутный шарик термометра должен находиться внутри шкафа на расстоянии6-8 см от верхней стенки. В верхней части сушильных шкафов имеется также отверстие для вентиляции, которое при стерилизации закрывают. Стерилизаторы и шкафы с электрическим обогревом снабжены терморегулятором, обеспечивающим автоматическое поддержание необходимой температуры.
Таблица 3 — Условия стерилизации стеклянной посуды сухим жаром
Температура, °С | Время, мин |
140 | 180 |
150 | 150 |
160 | 120 |
170 | 60 |
Подготовка посуды к стерилизации. Посуда перед стерилизацией долж-
на быть тщательно вымыта и завернута в бумагу для сохранения стерильности после прогревания. Посуду развертывают непосредственно перед употреблением.
В верхние концы пипеток вставляют ватные тампоны. Торчащие из пипеток волокна ваты сжигают в пламени горелки. Пипетки заворачивают в длинные полоски бумаги шириной 4 — 5 см. Обмотку начинают с оттянутого конца и постепенным движением бумаги по спирали заканчивают у конца с ватным тампоном. За-
вернутые пипетки для предохранения бумаги от загрязнения и разрывов перед стерилизацией упаковывают по несколько штук вместе или помещают в специальные металлические или картонные пеналы. Чашки Петри обычно заворачивают в пакеты по 2-4 штуки, шпатели — по отдельности, но затем, как и пипетки, их объединяют в общий сверток. Колбы, пробирки и трубки Бурри закрывают ватными пробками. На пробки можно надеть бумажные колпачки, предохраняющие горлышко от пыли.
14.Стерилизация: понятие,методы,режимы. | gabiya.ru
Стерилизация — (лат. sterilis — обеспложивание) или полное уничтожение микроорганизмов и их спор путем воздействия как физических факторов, так и химических препаратов.
В настоящее время действует отраслевой стандарт (ОСТ 42-21-2-85), определяющий методы, средства и режимы стерилизации и дезинфекции изделий медицинского назначения, который дополнен приказом № 408 и «Методическими указаниями по дезинфекции, предстерилизационной очистке и стерилизации предметов медицинского назначения», утвержденными М3 России 30 декабря 1998 г. № М У-287-113.
Стерилизации подвергаются все изделия, соприкасающиеся с раневой поверхностью, контактирующие с кровью или инъекционными препаратами, и отдельные виды медицинских инструментов, которые в процессе эксплуатации соприкасаются со слизистыми оболочками и могут вызвать их повреждения.
Методы стерилизации
Различают термические методы — физический: паровой, воздушный, гласперленовый (в среде нагретых шариков), а также ультрафиолетовое облучение воздуха помещений: перевязочных, процедурных, операционных. . В клинической практике чаще всего применяются термические методы стерилизации, которые заключаются в воздействии пара под избыточным давлением и температуры стерилиации (автоклавирование) и воздействии сухого горячего воздуха, достигающего температуры стерилизации (используются сухожаровые шкафы разной модификации).
Химические методы стерилизации осуществляются растворами дезинфицирующих средств или газами изделий из полиэтилена, аппаратуры для искусственной вентиляции легких (ИВЛ), различных эндоскопов с волоконной оптикой. К химическому методу относится газовая стерилизация оксидом этилена, окисью пропилена, бромистым метилом и их смесью, а также пароформальдегидный метод.
Ультразвуковой метод стерилизации. Стерилизация инфракрасным излучением. Радиационный метод в (установке с источником излучения для промышленной стерилизации изделий однократного применения). Выбор метода зависит от многих факторов, основными из которых являются:
1. Материал, из которого состоит изделие.
2. Конструкция изделия.
3. Сроки стерильности изделия.
4. Оперативность метода
Автоклав (от греч. ауто — сам и лат. клавис — ключ) — означает «самозапирание». Автоклавирование, или стерилизация в паровом стерилизаторе, применяется для процесса стерилизации инструмента, любых ИМН из металла, стекла, резины и текстиля, растворов, лигатурного шовного материала.
Режимы стерилизации
1-й режим — температура 132 °С, давление 2 атм., время 20 мин. Первый режим (основной) предназначен для стерилизации изделий из бязи, марли (перевязочного материала, белья и т.д.), стекла, включая шприцы с пометкой «200 ‘С», изделий из коррозийностойкого металла.
2-й режим — температура 120 °С, давление 1,1 атм., время 45 мин. Второй режим (щадящий) рекомендуется для изделий из тонкой резины, латекса (хирургические перчатки и т.д.) и отдельных видов полимеров (полиэтилен высокой плотности).
3-й режим — температура 134 °С — 5 мин, 2 атм.
Воздушный метод стерилизации
Проводится в воздушном стерилизаторе сухим горячим воздухом. Рекомендуется для стерилизации любых ИМН из металла, стекла, силиконовой резины.
Режимы стерилизации
1-й режим — температура 180 °С, время 60 мин. Первый режим (основной) предназначен для стерилизации изделий из стекла, включая шприцы с пометкой «200 °С», изделий из металла: хирургические, стоматоло-гические, гинекологические инструменты, в том числе коррозийнонестойких металлов.
2-й режим — температура 160 °С, время 150 мин. Второй режим (щадящий) предназначен для стерилизации изделий из силиконовой резины, а также деталей некоторых аппаратов и приборов.
Стерилизация растворами химических веществ Перекись водорода обладает выраженным обеззаражи-вающим свойством. Для стерилизации используется 6% раствор перекиси водорода — экспозиция 180 мин, температура 50 °С; при полном погружении для стерилизации изделий из полимеров, резины, стекла и коррозийнонестойких металлов экспозиция — 360 мин при темпера туре 18 “С. (срок стерильности — трое суток)
Стерилизация газами Стерилизация производится в стационарном газовом стерилизаторе. ОСТ рекомендует выполнять газовую стерилизацию ряда медицинских изделий окисью этилена или смесью ОБ. Стерилизации подвергают оптику, кардиостимуляторы, изделия из полимерных материалов, резины, стекла, металла, пластмассовых частей различных аппаратов. Практическое осуществление этого метода встречает значительные трудности, поэтому газовая стерилизация не получила еще того распространения, которого она заслуживает по своим возможностям.
Стерилизация автоклавированием — Справочник химика 21
Глюкоза — 10,0 г Дистиллированная вода — до 1 л Вначале растворяют веронал и желатин примерно в 250 мл воды при 56 °С, затем добавляют остальные реактивы. После стерилизации автоклавированием в течение 10 мин при 1 атм доводят pH до нужного значения. [c.110]На практике чаще всего используют влажную и сухую стерилизацию жаром, а также стерилизацию фильтрованием. Примером влажной стерилизации может служить стерилизация посуды и сред автоклавированием. [c.57]
Выбор режима автоклавирования. В микробиологической практике стерилизацию в автоклавах осуществляют при температуре в пределах 111—138°, т. е. 0,5 до 2,5 ати. Температура ниже 111° Не может считаться надежной температура выше 138°, как правило, не является необходимой, к тому же, чем выше давление пара, тем сложнее условия эксплуатации автоклава. При использовании автоклавов без вакуумных насосов наиболее надежными считаются следующие режимы стерилизации 15—45 мин при 121° (1 ати) и 10—30 мин при 128° (1,5 ати). Микробиологи чаще всего стерилизуют среды при 0,5 и 1 атг/. [c.33]
Прп оценке возможности применения иолимерных. материалов в медицине необ.ходимо учитывать их устойчивость к воздействию 1)азличных видов стерилизации обработке водяным паром прп избыточном давлении 12() кп М-, или 1,2 кгс/см» (автоклавирование) прогреву до 120—130 С в течение 30. ИИ (т. наз. сухожарная стерилизация) обработке этиленоксидом или др. газами (газовая стерилизация) обработке р-рами гидроперекисей, хлорамина, четвертичных аммониевых оснований и др. облучеишо -луча ш, ускоренными элет тронами (радиационная стерилизация). Механизмы процессов, протекаюнщх ири стерилизации полимерных материалов, еще мало изучены. [c.183]
Стандартные приемы стерилизации жидких сред описываются в гл. 23 этого руководства. Для предотвращения распада термолабильных компонентов среды используют стерилизацию фильтрованием. Небольшие объемы простых сред, используемых для культивирования бактерий, автоклавируют непосредственно перед их использованием, но для автоклавирования больших объемов [c.407]
Для достижения температур выше точки кипения воды пользуются автоклавом. Температура насыщенного пара зависит от давления (рис. вЛ2). При доступе воздуха определенному давлению соответствует значительно более низкая температура. Поскольку гибель микроорганизмов под действием влажного жара зависит от температуры, а не от давления, необходимо закрывать автоклав лишь после того, как воздух будет из него вытеснен водяным паром. Воздух удаляется вместе с выходящим паром или в результате отсасывания. При автоклавировании следует измерять температуру, а не давление, хотя по соображениям простоты и безопасности обычно все еще измеряют давление. Продолжительность стерилизации, естественно, зависит от объема (теплоемкости) сосудов, в которых ее проводят (табл. 6.6). [c.208]
При изучения химической и термической устойчивости смол испытание выдержала лишь смола КУ-2. Как уже указывалось, химическая и температурная устойчивость катионитов совершенно обязательны при работе с кровью, так как это обеспечивает неизменность состава крови и позволяет проводить ее заготовку в стерильных условиях. Следует подчеркнуть, что при каждой обработке крови катионит дважды подвергается стерилизации автоклавированием в течение 30 мин. при 120° и 1,2 атм. давления. Хотя катионит в течение 1,5 лет работы подвергался многочисленному автоклавированию и регенерации, каких-либо заметных изменений обменной емкости и других свойств установить не удалось. С увеличением числа регенераций смола только несколько светлеет. [c.189]
Стерилизация насыщенным паром под давлением (автоклавирование) [c.29]
Укупорку культуральных сосудов — пробки или завинчивающиеся крышки — подвергают такой же обработке, как и всю посуду 1) укупорку на этапе мытья с детергентом и последующим полосканием в горячей проточной воде можно подвергнуть кипячению 2) после мытья укупорку следует рассортировать по размерам и разложить в чашки Петри, затем завернуть чашки в бумагу или фольгу 3) стерилизовать (для этих изделий допустим только один способ стерилизации) автоклавированием в течение 30 мин при температуре 121 °С. [c.38]
Культивирование гриба на жидких средах без автоклавирования, перемешивания и принудительной аэрации проводят без предварительной стерилизации среды, ее просто нагревают до кипения, разливают в деревянные каркасы, покрытые изнутри полиэтиленовой пленкой. Среду, охлажденную до 35—40°С, засевают сухими спорами. Сверху каркасы закрывают полиэтиленовой пленкой, которую после образования спороносной пленки гриба снимают. [c.77]
Как добавлять субстрат Если микроорганизм не загрязнен и хорошо растет, то прибавлять к нему субстрат можно несколькими способами. В том случае, когда не требуется специального оборудования, следует открыть колбу, добавить в нее субстрат и снова закрыть колбу, естественно соблюдая все условия асептики. Правда, риск внести загрязнение в этом случае много меньше, чем в начале выращивания культуры, вследствие того что питание уже истощено, а сильно разросшаяся культура будет подавлять рост любого другого организма. Жидкие субстраты вносятся как таковые, а твердые субстраты, тщательно очищенные, иногда могут быть добавлены и сами по себе, но чаще всего используются их растворы. К счастью, обычно нет необходимости подвергать субстрат стерилизации, поскольку большинство органических соединений неустойчиво в условиях автоклавирования. Тем не менее для уменьшения риска внести загрязнение при применении водных растворов используют стерильную воду. [c.219]
Стерилизация посуды производится в сушильном шкафу при 160 С в течение 1 часа или в автоклаве при 1 атм в течение 30 минут. При правильно произведенной стерилизации в сушильном шкафу бумага, в которую завертывается посуда, слегка буреет. После автоклавирования посуда вместе с оберточной бумагой просушивается. [c.184]
Условия проведения микробиологических трансформаций стероидов являются общими для всех реакций с микроорганизмами. Необходимой предпосылкой работы с чистыми культурами является стерильность всех операций, позволяющая избежать заражений. Стерилизация, в зависимости от объекта, осуществляется автоклавированием при 110—120°, [c.46]
В результате испытаний по режиму дезинфекция, мойка и стерилизация с использованием моющего раствора «Новость» с переки-. СЬЮ водорода, стерилизации — химической (6% раствор перекиси водорода), воздушной и паровой (автоклавирование) коррозионные потери не превышали 0,001 г/м без изменения поверхности. [c.47]
Посуду можно стерилизовать и в автоклаве. Режим стерилизации в этом случае существенно зависит от объема сосудов и толщины стекла (см. табл. 4). Для автоклавирования посуду готовят, как и для сухожаровой стерилизации. Следует иметь в виду, что в автоклаве посуда увлажняется. [c.38]
Трубки для переливания крови, бактериологические вакуу

ТОП 10: |
⇐ ПредыдущаяСтр 60 из 96Следующая ⇒ Правила безопасности при работе с автоклавом Стерилизационная и водопаровая камеры выполнены из нержавеющей стали и представляют собой единую сварную конструкцию, но они разобщены функционально. Вентиль позволяет перекрыть поступление пара в стерилизационную камеру при загрузке, стерилизации и разгрузки стерилизатора, сохраняя тем самым рабочее давление в водопаровой камере для последующих циклов стерилизации. Крышка через кольцевую резиновую прокладку с помощью шести винтовых прижимов создает необходимую герметичность рабочей камеры. Цилиндрический кожух с опорой на три ножки служит для уменьшения тепловых потерь и является несущим элементом конструкции. Вода заливается в водопаровую камеру через воронку. Для наблюдения за уровнем воды имеется стекло водоуказательного столбика. Нагрев воды осуществляется электронагревателями, установленными в нижней части водопаровой камеры. Сушка простерилизованного материала происходит под вакуумом, который создается с помощью инжектора. После окончания инжекции для восстановления в стерилизационной камере нормального атмосферного давления в нее подается через фильтр очищенный воздух. Указателем давления внутри стерилизационной камеры служит мановакуумметр. Через вентиль осуществляется выпуск конденсата, а также происходит периодическая продувка стерилизационной камеры паром в процессе стерилизации. Включение стерилизатора осуществляется поворотом ручки выключателя, при этом загорается сигнальная лампа «Сеть». При наличии уровня воды в водопаровой камере включаются электронагреватели. Для защиты электронагревателей от перегорания, в случае снижения уровня воды в водопаровой камере ниже минимального, предусмотрено специальное устройство, которое автоматически отключает электронагреватели. Чувствительным элементом этого устройства является датчик уровня воды. Снижение уровня воды ниже минимального сигнализируется включением сигнальной лампы «Воды нет». Стерилизатор имеет устройство для автоматического поддержания рабочего давления. Датчиком этого устройства является электроконтактный манометр, стрелки подвижных контактов которого устанавливаются на метках шкалы, которые соответствуют границам допустимого изменения рабочего давления. В стерилизаторе имеется предохранительный клапан, отрегулированный на давление пара 0,23±0,26 МПа (2,3±2,6 кг/см). Для подключения защитного заземления на электрощите и кожухе стерилизатора есть специальные болты. К работе с автоклавом допускается только специально подготовленный персонал. Порядок работы с автоклавом Включите выключатель, при этом загорится сигнальная лампа. При достижении давления пара в водопаровой камере 0,11 МПа (1,1 кг/см) откройте выпускной вентиль на 1/2 оборота. При этом давление пара в стерилизационной камере должно быть в пределах (0,01-0,02) МПа (0,1-0,2 кг/см). Выпуск воздуха из стерилизационной камеры должно продолжаться в течение 10 минут. Закройте вентиль по окончании продувки и доведите давление в стерилизационной камере до показания соответствующего режиму стерилизации. При достижении заданного рабочего давления, которое совпадает с первым автоматическим отключением электронагревателей, отметьте время начала стерилизации. Стерилизация в стерилизаторе осуществляется водяным насыщенным паром с температурой (132±2) °С, давлением (2±0,02) атм. в течение (20±2) минут; при температуре (120±2) °С, давлении (1,1±0,02) атм. в течение (45±3) минут. В начале стерилизации рекомендуется 1-2 раза открывать вентиль в течение 30 с. Это позволит вытеснить конденсат, который накапливается в стерилизационной камере и способствует лучшему проникновению пара в толщу стерилизуемого материала. По истечении времени стерилизации закройте вентиль, выпустите пар и конденсат из стерилизационной камеры через вентиль, оставив внутри стерилизационной камеры давление в пределах (0,01-0,02) МПа (0,1-0,2) кгс/см по мановакуомметру и высушите простерилизованный материал. Методы подготовки рук к операции Обработка рук – важное средство профилактики контактной инфекции. Врачи-хирурги, операционные и перевязочные сестры должны постоянно заботиться о чистоте рук, ухаживать за кожей и ногтями. Наибольшее количество микроорганизмов скапливается под ногтями, в области ногтевых валиков, в трещинах кожи. Уход за руками предусматривает предупреждение трещин кожи, стрижку ногтей (они должны быть короткими), удаления заусенцев. Работу, связанную с загрязнением и инфицированием кожи рук, следует выполнять в перчатках. Правильный уход за руками следует рассматривать как этап в подготовке их к операции. Обработка рук любым способом начинается с механической очистки. К классическим методам обработки рук относятся способы Фюрбрингера, Альфельда, Спасокукоцкого-Кочергина, что сейчас практически не применяются из-за своей громоздкости и продолжительность. Способы Фюрбрингера, Альфельда и другие предусматривают предварительное мытье рук стерильной щеткой и мылом. Щетку держат в правой руке, намыливают мылом, потом мыло укладывают на тыльную поверхность щетки и удерживают ладонью, в которой находится щетка. Щетка или салфетка должны перемещаться в направлении от пальцев к предплечью, кисти находятся выше предплечий, и поток теплой проточной воды направляется от пальцев до локтя. В таком положении начинают и заканчивают мытье щеткой, не допуская стекания воды от локтя до кисти. Сначала моют ладонную поверхность каждого пальца, затем тыльную поверхность и ногтевое ложе, межпальцевые промежутки левой кисти, затем правой, затем ладони и тыл левой и правой кистей и, наконец, предплечья до границы их верхней и средней трети. Мыльную пену постоянно смывают проточной водой, щетку намыливают по мере необходимости. За все время мытья руки не должны прикасаться к кранам, поток воды и ее температуру регулируют перед мытьем. После законченного мытья щетку и мыло кладут на столик, руки ополаскивают водой и, как и раньше, держа кисти рук на уровне груди, просушивают кожу стерильными марлевыми салфетками или полотенцем, не прикасаясь к невымытым участкам кожи. Далее (в зависимости от способа обработки) пальцы, кисти, нижнюю треть предплечий протирают салфетками, густо смоченными спиртом, раствором церигеля или другим антисептиком, по способу Альфельда руки протирают 96 % спиртом в течение 5 минут, по способу Фюрбрингера – после механической очистки руки протирают в течение 1 минут раствором сулемы 1:1000 и затем 96 % спиртом в течение 3 минут, окончания ногтевого ложа обрабатывают 5 % настойкой йода. Способ Спасокукоцкого-Кочергина предусматривает механическую очистку рук 0,5 % раствором нашатырного спирта. Руки моют в двух тазах по 3 минут салфеткой, последовательно выполняют движения как при мытье щеткой, начиная от пальцев левой руки. В первом тазу руки моют до локтей, во втором – к границе верхней и средней трети предплечья. После окончания мытья руки ополаскивают раствором нашатырного спирта и кисти поднимают вверх так, чтобы капли воды стекали до локтей. С этого времени кисти рук постоянно находятся выше предплечий. Кожу рук осушают стерильными салфетками: сначала обе кисти (эту салфетку бросают), затем последовательно нижнюю и среднюю треть предплечий. Обеззараживают кожу салфетками, смоченными 96 % спиртом, обрабатывая дважды по 2,5 минут кисти до нижней трети предплечья, затем кончики пальцев, ногтевые валики; ногтевые ложа и складки кожи пальцев смазывают 5 % спиртовым раствором йода. В настоящее время наиболее распространенными способами мытья рук является способ обработки рук первомуром (препарат С-4), гибитаном (хлоргексидином) и т.п. Обработка рук первомуром (препарат С-4). Первомур – смесь, состоящая из муравьиной кислоты и перекиси водорода. Сначала готовят основной раствор в соотношении 81 мл 85 % муравьиной кислоты и 171 мл 33 % раствора перекиси водорода, которые смешивают в посуде с притертой пробкой и помещают в холодильник на 2 часа. При взаимодействии муравьиной кислоты и перекиси водорода образуется муравьиная кислота, обладающая сильным бактерицидным действием. Из указанного количества основного раствора можно приготовить 10 л рабочего раствора первомура, смешав его с дистиллированной водой – рабочий раствор годен к применению. При подготовке раствора необходимо работать в резиновых перчатках для предотвращения ожогов концентрированными растворами муравьиной кислоты или перекиси водорода. Обработка рук предусматривает предварительное мытье их в течение 1 минуты проточной водой с мылом. Затем кисти и предплечья до уровня средней трети моют салфетками в тазу с раствором первомура в течение 1 минуты и осушают стерильными салфетками; в одном тазу обработку рук могут сделать 5 человек. Обработка рук хлоргексидином биглюконатом, который выпускается в виде 20 % водного раствора. Для обработки рук готовят 0,5 % спиртовой раствор: 500 мл 70 % спирта добавляют до 12,5 мл 20 % раствора хлоргексидина биглюконата. Предварительно моют руки проточной водой с мылом, осушают стерильными салфетками, а затем протирают марлевым тампоном, смоченным приготовленным раствором в течение 2-3 минут. Ускоренные способы обработки рук применяют в амбулаторной практике или в экстренных случаях. Для ускоренного обеззараживания рук используют пленкообразующий препарат церигель, отличающийся сильным бактерицидным действием. В его состав входят поливинилбутирол и 96 % этиловый спирт. Руки моют водой с мылом, тщательно осушают. На ладонь наливают 3-4 мл церигеля и тщательно смачивают им пальцы, ногтевые ложа и валики, кисти и нижнюю часть предплечья. Полусогнутые пальцы держат в расслабленном состоянии в течение 2-3 минут, пока на коже не образуется пленка церигеля. Образовавшаяся пленка, имеет защитные и бактерицидные свойства, по окончании операции она легко снимается марлевыми шариками, смоченными спиртом. Обработку рук в экстремальных условиях можно сделать путем протирания кожи 96 % этиловым спиртом в течение 10 минут (способ Бруна) или в течение 3 минут 2 % спиртовым раствором йода. Приобретает распространение обработка рук в специальных устройствах с применением ультразвука. |

ТОП 10: |
Данный способ стерилизации питательных сред является наиболее надежным и чаще всего применяемым. Он основан на нагревании материала насыщенным водяным паром при давлении выше атмосферного. Известно, что температура пара возрастает при повышении его давления (табл. 4.1). Совместное действие высокой температуры и пара обеспечивает особую эффективность этого процесса. При этом погибают и вегетативные клетки, и споры микроорганизмов. Установлено, что споры большинства микроорганизмов не выдерживают и 5-минутную экспозицию в насыщенном паре при 121 °С. Лишь споры некоторых почвенных бактерий погибают при 1 ати только через 30 мин. Таблица 4.1 Температура насыщенного пара при разных давлениях
ати* — избыточное атмосферное давление
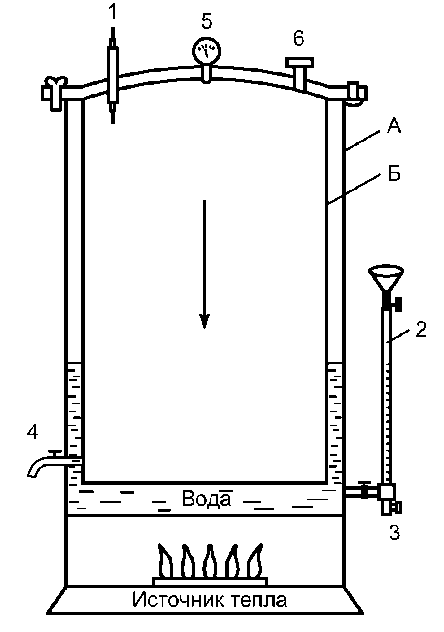
Рис. 4.1. Схема автоклава:
1 — стерилизационная камера; 2 — кран для выхода воздуха; 3 — манометр; 4— предохранительный клапан; 5— водопаровая камера; 6 — воронка для заполнения автоклава водой; 7 — водомерная трубка; 8 — отверстия для поступления пара в стерили-зационную камеру; 9 — защитный кожух; 10 — крышка автоклава; 11 — подставка для размещения стерилизуемых предметов
Стерилизацию паром под давлением осуществляют в специальных герметически закрывающихся толстостенных аппаратах — автоклавах. Автоклавы разнообразны по форме, размерам, рабочему давлению, конструкции и другим показателям. Они могут быть с ручным управлением, полуавтоматические и автоматические, но, поскольку все автоклавы предназначены для выполнения одной и той же задачи — стерилизации, основной принцип их устройства один и тот же. На рис. 4.1 показана схема вертикального автоклава с ручным у правлением. Автоклав представляет собой металлический двустенный резервуар, способный выдержать высокое давление. Его внутренняя часть является стерилизационной камерой (7). В нее помещают стерилизуемый материал. Стерилизационная камера снабжена краном (2) для выхода воздуха, манометром (3) для определения давления пара и предохранительным клапаном (4) для выхода пара при повышении давления сверх необходимого и для предотвращения разрыва автоклава. Пространство между стенками, называемое водопаровой камерой (5), заполняется через воронку (6) водой (лучше дистиллированной, чтобы не образовывалась накипь) до определенного уровня, который отмечен на специальной водомерной трубке автоклава (7). Выше этого уровня воду наливать не следует, так как при бурном кипении вода может попасть в трубку, ведущую к манометру и исказить его показания. В верхней части внутренней стенки водопаровой камеры имеются отверстия (8), через которые пар поступает в стерилизационную камеру. Паровой котел сверху покрыт защитным кожухом (9). Он предохраняет котел от механических повреждений, а работающего около автоклава — от ожогов. Для создания герметичности автоклав плотно закрывают массивной крышкой (10) с резиновой прокладкой. Стерилизуемые предметы помещают на специальную подставку (11). Процесс автоклавирования. Отдельные операции процесса стерилизации в автоклавах разных типов могут быть несколько различными. Соответственно несколько различается и техника работы с ними, однако общий принцип проведения стерилизации в разных автоклавах одинаковый. Перед работой осматривают автоклав и контрольно-измерительную аппаратуру. При наличии любой неисправности (смещение стрелки манометра с нуля, трещина на водомерной трубке и др.) работать с прибором нельзя. После осмотра автоклава в водопаровую камеру наливают воду до верхней отметки на водомерной трубке. В стерилизационную камеру на специальную подставку из дерева помещают стерилизуемый материал. Предметы следует размещать не слишком плотно, так как пар должен свободно проходить между ними, иначе они не нагреются до нужной температуры и могут остаться нестерильными. Загрузив стерилизационную камеру, устанавливают и плотно завинчивают крышку (дверь) автоклава. Затем открывают кран, соединяющий стерилизационную камеру с наружным воздухом, и включают нагрев. После начала парообразования удаляют воздух из стерилизационной камеры. Это необходимое условие стерилизации, так как при одном и том же давлении температура чистого пара выше температуры смеси пара и воздуха. Если в автоклаве останется воздух, материал может не простерилизоваться. Наиболее простой и очень распространенный способ освобождения автоклава от воздуха — вытеснение воздуха паром. Пар и конденсат отводят либо в сосуд с водой, либо в специальное устройство, соединенное с канализацией. В первом случае на кран (2) надевают резиновый шланг, который опускают в воду. Началом продувания считается появление устойчивой непрерывной струи чистого пара. Пока в автоклаве еще имеется воздух, смесь воздуха и пара, проходя через воду, издает сильный треск. Чистый пар выходит с равномерным шипящим звуком. Его пропускают в течение 10 мин. В целом вся операция с момента появления пара с воздухом должна занимать не более 15 — 20 мин, иначе в автоклаве останется мало воды и он может испортиться. Чтобы уменьшить расход пара (воды), кран открывают не полностью. Степень открывания крана устанавливают на практике при эксплуатации автоклава. В наиболее совершенных автоклавах воздух из стерилизационной камеры удаляют с помощью вакуумного насоса. Когда воздух вытеснен, закрывают пароотводной кран, и давление пара доводят до показания, соответствующего режиму стерилизации. Режим автоклавирования часто выражают в единицах избыточного давления, указывая при этом длительность его поддержания, например стерилизация при 1 ати в течение 20 мин. На манометре автоклава обозначается именно то избыточное давление, которое создается в автоклаве сверх нормального. Нередко режим автоклавирования характеризуется температурой и временем. Как только стрелка манометра дойдет до указателя определенного дополнительного давления и, следовательно, температура пара достигнет соответствующего значения, этот уровень давления пара поддерживают в течение необходимого времени путем ручного или автоматического регулирования подачи пара. В автоматических автоклавах подачу пара регулируют электроконтактным манометром. По окончании времени стерилизации выключают нагрев автоклава. Давление в автоклаве постепенно падает и сравнивается с атмосферным. Лишь после этого открывают кран, выводящий пар. Преждевременное открывание крана недопустимо, так как перегретые среды при резком снижении давления сразу же бурно закипают, смачивают и даже иногда выталкивают ватные пробки, что нарушает стерильность материала. Когда пар выйдет, открывают крышку (дверь) автоклава, соблюдая при этом осторожность во избежание ожога паром лица и рук. Удаление пара из стерилизационной камеры автоклавов, оснащенных вакуумным насосом, осуществляют с помощью насоса. Одновременно происходит подсушивание стерильного материала. Поскольку автоклав работает при высоких давлениях и температурах, неправильное обращение с ним может быть причиной несчастных случаев. Установка автоклава и работа с ним производятся при точном и строгом выполнении правил, указанных в прилагаемой к автоклаву инструкции. К работе допускаются только подготовленные лица, имеющие специальное разрешение. При необходимости проконтролировать температуру в автоклаве пользуются разными веществами, плавящимися при определенной температуре. Эти вещества предварительно смешивают с нейтральными красителями и помещают в автоклав до начала стерилизации. В качестве индикаторов температуры используют фенантрен (температура плавления 98—100°С), бензаурин (115°С), серу (119 °С), бензойную кислоту (121 — 122 °С), мочевину (132°С), глюкозу (146°С), тиомочевину (180°С), аскорбиновую кислоту (187— 192 °С). На 100 г этих веществ берут 0,01 г красителя (фуксин, метиленовый синий), тщательно смешивают, рассыпают в стеклянные трубочки с одинаковым диаметром и толщиной стенок, запаивают и в вертикальном положении раскладывают между стерилизуемым материалом в автоклаве. По достижении в сосуде соответствующей температуры эти вещества расплавляются и окрашиваются в цвет добавленного в них красителя.
Подготовка сред к стерилизации. При автоклавировании 3 — 5 % жидкости теряется в результате испарения, поэтому рекомендуется в приготавливаемые среды добавлять сверх объема примерно 5 % дистиллированной воды. Тогда после стерилизации среда (раствор) будет иметь требуемую концентрацию. Среды обычно стерилизуют в пробирках, колбах, бутылях. Емкости заполняют средой не более чем на половину их высоты, чтобы предотвратить смачивание пробок. Сосуды со средами закрывают ватными пробками. Они предохраняют среду от заражения микроорганизмами, находящимися в окружающем воздухе. Пробки должны быть достаточно плотными, чтобы выполнять эту функцию, но с достаточно равномерным распределением волокон ваты, так как через них происходит газообмен культур с окружающей средой. Слишком плотные пробки затрудняют снабжение культур воздухом. Для приготовления пробки плоский кусок ваты, взятый вдоль волокна, скатывают валиком. Чтобы придать пробке прочность, ее прокатывают между ладонью и чистым стеклом, лежащим на столе. Длина пробки для обычной пробирки примерно 4 см. Пробка должна входить в пробирку на 1,5 — 2,0 см (рис. 4.2). Для сохранения формы пробку вынимают из горлышка, слегка вращая. Удобно обернуть пробку чистой марлевой салфеткой. Перед стерилизацией пробки можно прикрыть бумажными колпачками. Нельзя обертывать пробки сосудов, которые будут стерилизоваться в автоклаве, целлофаном, фольгой или другими материалами, не пропускающими пар, так как пар должен проникать через пробку в сосуд, иначе среды не нагреются до нужной температуры и не простерилизуются. При использовании стеклянных, резиновых, корковых и других пробок их завертывают в двойной слой оберточной бумаги и стерилизуют привязанными к склянке, закрытой ватной пробкой. Пробки в сосуде меняют стерильно около пламени горелки. |