2.8. Дезинфекция и стерилизация перчаток
/Приказ МЗ СССР N 408 от 12.07.1989 г./
Способы дезинфекции перчаток:
проточной воде, просушивание;
в проточной воде, просушивание;
перекисью водорода на 60 мин, прополаскивание, просушивание.
Стерилизация перчаток:
автоклавирование при температуре 120 гр.С, 1,1 атм., в течение 45 мин..
2.9 Методы и режимы дезинфекции и стерилизации эндоскопов и инструментов к ним
Обработка эндоскопов и инструментов к ним включает:
инструментальных каналов;
— дезинфекция;
— предстерилизационная очистка и стерилизация;
— просушивание.
В зависимости от вида эндоскопического исследования выделяют несколько групп инструментов, которым проводят различные виды обработки — стерилизацию, дезинфекцию высокого или низкого уровня.
Обязательной стерилизации подвергаются:
инструменты активно травмирующие слизистую оболочку и имеющие непосредственный контак с кровью /инструменты для взятия биопсии, коагуляторы, диатермические петли, папиллотомы, экстракторы и пр./;
эндоскопы, которые могут соприкасаться с поврежденной слизистой оболочкой, раневой поверхностью, контактировать с кровью и инъекционными препаратами;
эндоскопы и инструменты, использовнные у пациентов с положительными результатами анализов на вирусный гепатит, туберкулез, ВИЧ.
Дезинфенкции высокого уровня подвергаются изделия, имеющие активный контакт со слизистой оболочкой:
Дезинфекции низкого уровня подвергаются приспособления, не имеющие активного контакта со слизистой оболочкой обследуемых органов:
фото- и видеокамеры;
эндоскопическая «фурнитура»;
контейнер с водой для промывания объектива эндоскопа.
Режимы дезинфекции эндоскопических аппаратов и инструментов к ним
Дезинфицирующее средство | Режимы | Показания к применению | |
Концентрация, % | Время выдержки, мин. | ||
** Лизоформин-3000 | 2,0 1,5 0,75 | 15 30 | Инфекции бактериальные (+туберкулез), вирусные, кандидозы, эпидермофитии |
** Дезоформ | 1,0 3,0 5,0 | 60 30 10 | Инфекции бактериальные (+туберкулез), вирусные, кандидозы, эпидермофитии |
Сайдекс или Глюторал | 2,0 | 15 | Инфекции бактериальные (кроме туберку-леза) и вирусные |
2,0 | 90 | Туберкулез и патогенные грибы | |
*Виркон для гибких эндоскопов | 1,0 | 10 | Инфекции бактериальные (крому туберку-леза), вирусные |
Виркон для жестких эндоскопов | 2,0 | 10 | Инфекции бактериальные (кроме туберку-леза), вирусные |
Гибитан (хлоргексидин 20% спиртовый) | 0,5 | 15 | Инфекции бактериальные (кроме туберку-леза), вирусные |
*** Перекись водорода | 3,0 | 80 | Инфекции бактериальные (кроме туберку-леза) |
3,0 | 180 | Туберкулез | |
6,0 | 30 | Инфекции вирусной этиологии | |
*Септодор-Форте * * | 0,2 | 30 | Инфекции бактериальные (кроме туберку-леза) |
0,4 | 15 | Инфекции бактериальные (кроме тубер-кулеза) | |
0,4 | 60 | Вирусные инфекции | |
0,4 | 90 | Туберкулез | |
0,5 | 60 | Туберкулез | |
0,5 | 30 | Вирусные инфекции | |
0,7 | 15 | Вирусные инфекции | |
Секусепт-Форте | 1,5 30,0 | 60 30 | Бактериальные инфекции (кроме тубер-кулеза) |
50,0 | 30 | ||
30,0 50,0 | 30 15 | Дерматофитии, Кандидозы | |
Другие дезсредства, разрешенные Госэпиднадзором РФ для дезинфекции гибких и жестких эндоскопов
Примечание:
* дезинфекция и предстерилизационная очистка объеди-
нены в один процесс;
** в комбинации с 0,5% раствором Бланизола дезинфекция
и предстерилизационная очистка объединены в один про-
цесс;
*** перекись водорода применяется для обработи только тех
эндоскопов, в эксплуатационных документах на которые
указана возможность применения этого препарата;
— температура дезинфектантов 18-20 гр.С;
— дезинфекция производится путем погружения изделий в
дезинфектант с заполнением просветов всех каналов;
— при использовании средства Виркон эндоскопы предвари-
тельно очищаются в 0,5% его растворе, а затем погру-
жаются в 1% раствор /гибкие эндоскопы/.
Стерилизация оптических приборов
Основным методом стерилизации оптических инструментов, требующих наиболее щадящей обработки с исключением нагревания, является газовая стерилизация. Этим способом обрабатываются все инструменты для эндоскопических вмешательств, что связано с их сложным устройством и дороговизной.
Для этого используется:
стерилизация окисью этилена при концентрации газа 555 мг/л в течение 16-16 часов;
стерилизация в формалиновой камере, на дно которой кладут таблетки формальдегида, в течение 48 часов.
При стерилизации фиброгастроскопов, холедохоскопов, колоноскопов применяется замачивание в 2% р-ре глютарового альдегида (активатор) и гипохлорида натрия (ингибитор коррозии) в течение 45-180 минут.
Стерилизация перевязочного материала и белья
Перевязочный материал и белье стерилизуют в автоклаве при давлении 2 атм. (132,9 0С.) в течение 20 минут.
Белье и материал стерилизуются в биксах или матерчатых двухслойных мешках.
Существуют 3 вида укладки бикса:
Универсальная — в бикс или матерчатый комплект закладывают разный материал: шарики, салфетки, вату, халаты, тампоны и т. п. В этих случаях бикс делят на секторы, в каждом из которых находится тот или иной материал. Такая укладка применяется в хирургических отделениях с небольшим объемом работы.
Специализированная — в каждый из биксов укладывают один вид материала (халаты, салфетки и т.п.). Применяется в хирургических отделениях с большим объемом работы.
Целенаправленная — в бикс укладывается материал, который может потребоваться для определенного оперативного вмешательства.
Допустимый срок сохранения материала после стерилизации в биксах — 3 суток; в мешках — 24 часа.
Стерилизация перчаток
Предстерилизационная подготовка: перчатки моют проточной водой, а затем замачивают в растворе А (пергидроль — 20,0; ПАВ «Астра» — 5,0; вода — 975 мл.).
В настоящее время применяются следующие способы стерилизации перчаток:
Лучевая стерилизация – применяется в промышленных условиях. Основной метод стерилизации одноразовых перчаток.
Автоклавирование при давлении 1,1 атм. в течение 45 минут — при многократном использовании перчаток.
Кипячение в воде (без добавления соды) в течение 15 минут. Следует отметить, что этот способ применяется редко. Резиновые изделия быстро портятся.
Холодная стерилизация в 6 % растворе перекиси водорода, 0,5 % растворе детергента в течение 3-х часов при температуре 50 0С.
Химическая стерилизация в автоматических газовых стерилизаторах при концентрации окиси этилена 555 мг./л в течение 4-х часов.
В экстренных случаях для стерилизации перчаток используется обработка в течение 5 минут тампоном, смоченным 96 % спиртом.
Для поддержания стерильности по ходу операции перчатки обрабатывают 2.4 % первомуром и протирают 96 % этанолом.
Обработка рук хирурга
Одним из важнейших мероприятий по профилактике контактной инфекции является обработка (мытье) рук хирурга.
Предложено много методов для подготовки рук к операции. Все они могут быть разделены на две группы. В основу одной из них положена механическая очистка и дезинфекция, в основу других — только дубление кожи рук. Последние способы представляют исторический интерес и в настоящее время не применяются.
Основными способами обработки рук хирурга являются:
Метод Спасокукоцкого — Кочергина основан на растворении щелочным раствором аммиака жиров на поверхности и в порах кожи и вымывании вместе с ними бактерий. Предварительное мытье рук с мылом и щеткой не имеет достаточных оснований. Мыло в соединении с нашатырным спиртом образует нерастворимые калийные соли, которые закрывают поры кожи и препятствуют действию нашатырного спирта.
I этап — обычное обмывание рук с мылом в течение 1 минуты.
II этап — свежеприготовленный 0,5 % раствор нашатырного спирта наливают в два предварительно обожженных спиртом эмалированных тазика. Руки тщательно моют марлевой стерильной салфеткой или губкой в каждом тазике по 3 минуты, в первом тазике до локтя, во втором — только кисти и нижнюю часть предплечья.
III этап — осушивание рук стерильным полотенцем или салфеткой сначала кистей, потом предплечья;
IV этап — обработка рук 96 % этиловым спиртом (этанолом) в течение 5 минут, а затем ногтевых лож 5 % спиртовой настойкой йода.
Обработка рук дегмином и дегмицидом. Эти антисептики относятся к четвертичным аммониевым соединениям. Раствор антисептика заливают в емкость, в которую помещают стерильные губки. Руки обрабатывают 2 –мя губками по 3 минуты каждой, после чего высушивают стерильной марлевой салфеткой. Обработка рук 96 % этиловым спиртом или спиртовой настойкой йода не производится в связи с возможным дерматитом.
Обработка рук первомуром (раствором С-4).
Раствор С-4 готовят следующим образом: отмеренное количество перекиси водорода 33% (171 мл.) и 85% муравьиной кислоты (81 мл.) сливают в стеклянную колбу (вначале вливают перекись водорода, а затем муравьиную кислоту), встряхивают и ставят в холодильник на 90 минут. Это время необходимо для образования антисептического реагента — надмуравьиной кислоты, вызывающей образование тончайшей пленки на поверхности кожи, закрывающей поры и исключающей необходимость дубления. После этого содержимое рабочей смеси разводят дистиллированной водой — 10 литров. Раствор используется для обработки рук, а также операционного поля и может применяться в течение 1 суток (позднее обеззараживающий эффект теряется).
Раствор наливают в тазик, обеззараженный путем обжигания или протирания первомуром эмалированный. Руки предварительно моют с мылом в проточной воде 1 минуту (без щеток), осушивают полотенцем, а затем моют в растворе первомура в течение 1 минуты: 30 сек. до локтя и затем 30 сек. только кисти, после чего осушивают стерильной салфеткой в той же последовательности, как по методу Спасокукоцкого — Кочергина. Обработка 96 % этанолом и йодом не рекомендуется из-за возможного раздражения кожи рук. В одном тазике, не меняя раствора, могут вымыть руки 10 — 11 человек.
Недостатком метода является возможность развития дерматита на коже рук хирурга.
Обработка рук хлоргексидином биглюконатом (гибитаном). Используется 0,5% спиртовый раствор хлоргексидина. После предварительного мытья рук в проточной воде с мылом руки обрабатывают в тазике с 0,5% спиртовым раствором хлоргексидина в течение 3 минут. После осушивания стерильной салфеткой одевают резиновые перчатки.
Обработка АХД, АХД-специаль, евросептом. Препараты находятся в специальных флаконах, из которых при нажатии на определенный рычаг определенная доза антисептика выливается на руки хирурга, после чего производится обработка рук в течение 2-3 минут. Процедура выполняется дважды. Дополнительное высушивание и дубление не требуются.
Обработка рук церигелем. Церигель – пленкообразующий антисептик из группы детергентов. Методика: в течение 2-3-х минут церигель наносится на поверхность рук, при этом образуется пленка. Метод применяется в экстренных ситуациях, при выполнении кратковременных вмешательств и не требует одевания стерильных перчаток. В настоящее время применяется редко.
Обработка рук хирурга ультразвуком. Для быстрой обработки рук в последние годы сконструированы специальные аппараты с ультразвуковыми ваннами, в которых мытье и дезинфекция рук происходят в течение 1 минуты. Мытье осуществляется погружением рук в 0,05% водный раствор хлоргексидина, через который пропускают ультразвуковые волны, обеспечивающие» эффект мытья».
Обработка рук методом Бруна заключается в обработке 96 % этанолом в течение 10 минут. В настоящее время применяется редко.
Обработка рук растворами моющих средств ОП-7, «Новость», «Астра» используется при невозможности обработки рук с помощью других способов. Одну столовую ложку моющего средства растворяют в 3-х литрах теплой воды в эмалированном тазике, в котором моют руки в течение 3-х минут. После высушивания стерильной салфеткой руки протирают 96 % этанолом 3 минуты и надевают стерильные резиновые перчатки.
7. Принципы действия автоклава, методы стерилизации перевязочного материала и операционного белья.
Стерилизация паром под давлением (автоклавирование)
При этом способе стерилизации действующим агентом служит горячий пар. Стерилизацию просто текучим паром в настоящее время не используют, так как температура пара в обычных условиях (100 ?С) не достаточна для уничтожения всех микробов.
В автоклаве (аппарат для стерилизации паром под давлением) возможно нагревание воды при повышенном давлении (рис. 2-4). Это повышает точку кипения воды и соответственно температуру пара до 132,9 ?С (при давлении 2 атм).
Рис. 2-4. Автоклав (схема). Аи Б — наружная и внутренняя стенки автоклава; 1 — термометр; 2 — водомерное стекло; 3 — впускной кран; 4 — выпускной кран; 5 — манометр; 6 — предохранительный клапан
Хирургические инструменты, перевязочный материал, бельё и другие материалы загружают в автоклав в специальных металлических коробках — биксах Шиммельбуша (рис. 2-5). Биксы имеют боковые отверстия, которые перед стерилизацией открывают. Крышку бикса плотно закрывают.
После загрузки биксов автоклав закрывают герметичной крышкой и проводят необходимые манипуляции для начала его ра- боты в определённом режиме.
Работу автоклава контролируют при помощи показателей манометра и термометра. Существует три режима стерилизации:
• при давлении 1,1 атм (t = 119,6 ?С) — 1 ч;
• при давлении 1,5 атм (t = 126,8 ?С) — 45 мин;
• при давлении 2 атм (t = 132,9 ?С) — 30 мин.
\По окончании стерилизации биксы некоторое время остаются в горячем автоклаве для просушки при немного приоткрытой дверце. При извлечении биксов из автоклава закрывают отверстия в стенках биксов и отмечают дату стерилизации (обычно на прикреплённом к биксу кусочке клеёнки). Закрытый бикс сохраняет стерильность находящихся в нём предметов в течение 72 ч.
8. Методы контроля за стерилизацией.
Все действия по обработке и стерилизации инструментов, белья и прочего подлежат обязательному контролю. Контролируют как эффективность стерилизации, так и качество предстерилизационной подготовки.
Контроль стерильности
Методы контроля стерильности делят на прямой и непрямые. Прямой метод
Прямой метод контроля стерильности — бактериологическое исследование: специальной стерильной палочкой проводят по стерильным инструментам (коже рук хирурга или операционного поля, опе- рационному белью и пр.), после чего помещают её в стерильную пробирку и отправляют в бактериологическую лабораторию, где проводят посев на различные питательные среды и таким образом определяют бактериальную загрязнённость.
Бактериологический метод контроля стерильности наиболее точен. Отрицательный момент — длительность проведения исследования: результат посева бывает готов лишь через 3-5 сут, а использо- вать инструменты нужно непосредственно после стерилизации. Поэтому бактериологическое исследование проводят в плановом порядке и по его результатам судят о методических погрешностях в работе медицинского персонала или дефектах используемого оборудования. По существующим нормативам, несколько различающимся для разного вида инструментария, бактериологическое исследование необходимо проводить 1 раз в 7-10 дней. Кроме того, 2 раза в год подобные исследования во всех подразделениях больницы проводят районные и городские санитарно-эпидемиологические службы.
Непрямые методы
Непрямые методы контроля используют в основном при термических способах стерилизации. С их помощью можно определить величину температуры, при которой проводили обработку, не давая точный ответ на вопрос о присутствии или отсутствии микрофлоры. Преимущество непрямых методов в быстроте получения результата и возможности их использования при каждой стерилизации.
При автоклавировании в бикс обычно укладывают ампулу (пробирку) с порошкообразным веществом, имеющим температуру плав- ления в пределах 110-120 ?С. После стерилизации при открытии бикса сестра прежде всего обращает внимание на эту ампулу: если вещество расплавилось, то материал (инструменты) можно считать стерильными, если же нет — нагревание было недостаточным и пользоваться таким материалом нельзя, так как он нестерилен. Для подобного метода наиболее часто используют бензойную кислоту (температура плавления 120 ?С), резорцин (температура плавления 119 ?С), антипирин (температура плавления 110?С). Вместо ампулы в бикс можно поместить термоиндикатор или максимальный термометр, по которому также можно определить, какова была температура во время обработки.
Аналогичные непрямые способы используют при стерилизации в сухожаровом шкафу. Однако здесь применяют вещества с более вы- сокой температурой плавления (аскорбиновая кислота — 190 ?С, янтарная кислота — 190 ?С, тиомочевина — 180 ?С), другие термоиндикаторы или термометры
13. Стерилизация неколющих, нережущих инструментов, белья, перчаток, перевязочного материала.
Стерилизация нережущих инструментов(зажимы, пинцеты, зонды, пластинки, винты, стержни): основным методом является стерилизация горячим воздухом в сухожаровом шкафу или в автоклаве при стандартных режимах. Возможно также использование кипячения. кипячение в 2% растворе соды в течение 30 минут. Инструменты, загрязненные гноем, кипятят 45 мину. Инструменты после операции по поводу анаэробной инфекции и в группе риска по гепатиту кипятить не следует. Некоторые виды простых инструментов (пинцеты, зажимы, зонды и др.), предназначенные для одноразового использования могут стерилизоваться лучевым способом.
Стерилизация перчаток: автоклавирование. При многократной стерилизации резина теряет свою эластичность, трескается.(минус использования автоклава) Допустимо кипячение в течение 15 минут.
Для перчаток основной метод автоклавирование в щадящем режиме: после предстерилизационной обработки перчатки высушивают, пересыпают тальком (предупреждает слипание), заворачивают в марлю, укладывают в бикс и автоклавируют при 1,1 атм., в течение 30-40 минут или при 1,5 атм. – 15-20 минут.
В экстренных случаях хирург надевает перчатки и в течение 5 минут обрабатывает их шариком, смоченным 96% этиловым спиртом.
После надевания уже стерильных перчаток обычно их обрабатывают шариком со спиртом для снятия с поверхности талька.
Стерилизация перчаток осуществляется в паровом стерилизаторе, кипячением в дистиллированной воде или погружением в антисептический раствор. Перед стерилизацией для проверки целости перчатки надувают воздухом и погружают в воду. Выход пузырьков воздуха свидетельствует о наличии в перчатках отверстий. Такие перчатки подлежат замене. Перед началом стерилизации перчатки пересыпают снаружи и изнутри тальком. В каждый палец вводят полоску марли. Перчатку перекладывают и завертывают марлей. Стерилизация в автоклаве приводит к быстрой порче перчаток, потере ими эластичности. Поэтому целесообразнее перчатки кипятить в стерилизаторе в дистиллированной воде в течение 40 мин. Дно стерилизатора покрывают марлей, на которой перчатки должны лежать без перегибов. Для работы в перевязочной можно стерилизовать перчатки в растворе Синицына (борная кислота — 5 г, натрия карбонат — 75 г, формалин — 100 г, фенол — 16,5 г, дистиллированная вода — 5000 г) в течение 3 ч или в 2%-ном растворе хлорамина в течение 30 мин. Чтобы перчатки не всплывали, в них вкладывают груз. Простерилизованные перчатки извлекают из раствора стерильным корнцангом, с обеих сторон протирают стерильным полотенцем, пересыпают стерильным тальком и хранят в стерильном биксе завернутыми в стерильную салфетку (полотенце). После операции, не снимая перчаток, их моют теплой проточной водой с мылом. Затем подвергают предстерилизационной очистке, дезинфекции и стерилизации в соответствии с требованиями стандарта и инструкции
Стерилизация белья и перевязочного материала:
Операционное белье – хирургические халаты, простыни, полотенца, подкладные. (Хлопчатобумажные ткани) После использования проходят стирку отдельно от других видов белья.
Перевязочный материал – готовят перед стерилизацией. Повторно не используется, сжигается.
Перевязочный материал и белье стерилизуют автоклавированием при стандартных режимах. Перед стерилизацией их укладывают в биксы. Существует три вида укладки в биксы:
Универсальная укладка: бикс условно разделается на секторы, и каждый из них заполняется определенным видом перевязочного материала и белья. Обычно используется при работе в перевязочной и при малых операциях.
Целенаправленная: в бикс укладываются все инструменты, первязочный материал и белье, необходимые для осуществления процедуры. Предназначена для выполнения типичных манипуляций, процедур и малых операций.
Видовая: в один бикс укладывают только один вид перевязочного материала или белья. Обычно используют в операционных, где требуется большое количество стерильного материала.
Добавлено!!!!
Этап 1 —подготовка материала. Перевязочный материал должен легко стерилизоваться и не терять при этом своих свойств. Его готовят из марли и ваты, реже из вискозы и лигнина. Для работы из них готовят шарики, салфетки, тампоны, турунды, бинты. Марля должна складываться так, чтобы не было свободного края, из которого могут осыпаться волокна ткани. Материал заготавливают впрок, пополняя его по мере расходования. Перед стерилизацией его укладывают следующим образом: шарики – в марлевые мешочки по 50—100 штук, салфетки связывают по 10 штук. В качестве операционного белья используют хирургические халаты, простыни, пелёнки, полотенца, шапочки, бахилы. Их изготавливают из хлопчатобумажной ткани. Халаты, простыни, пеленки, полотенца для стерилизации складываются в виде рулонов, это позволяет легко развернуть их при использовании. Перевязочный материал после его использования сжигается. Белье многократного применения стирается, но отдельно от других видов белья. Этап 2 – укладка материала. Перевязочный материал и операционное белье стерилизуют в биксах. Применяют три вида укладки бикса: • универсальная укладка • целенаправленная укладка • видовая укладка Универсальная – укладывают материал и белье для одной небольшой, типичной операции. Этот вид укладки используют при работе в перевязочных и при малых операциях. Укладку производят по секторам. Бикс делят на секторы, которые заполняются определенным видом материала или белья: в один сектор помещаются салфетки, в другой – шарики, в третий – тампоны и т. д. Целенаправленная – укладывают материал и белье для определенной операции. Например, для аппендэктомии, резекции желудка. В бикс укладывается набор перевязочного материала и белья, необходимый для осуществления операции. Видовая – укладывают определенный вид материала или белья. Этот вид укладки применяют в операционных, где выполняется большое количество различных операций. Укладка осуществляется следующим образом – в один бикс хирургические халаты, в другой – простыни, в третий – салфетки и т. д. Укладку бикса осуществляют следующим образом. Проверяют исправность бикса. Протирают дно, стенки, крышку бикса вначале изнутри, а затем снаружи 0,5 % нашатырным спиртом. На боковой стенке бикса круговую пластинку (поясок герметичности), сдвигают так, чтобы открыть боковые отверстия. Бикс выстилается сложенной вдвое простыней, при этом концы её должны свисать наружу. На дно бикса кладут индикатор контроля стерильности. Перевязочный материал и белье укладывают в бикс рыхло, вертикально, по секторам или послойно. Каждый предмет кладут так, чтобы легко было достать, не нарушая укладку. В середину бикса кладут ещё индикатор контроля стерильности. Края простыни выстилающей бикс заворачивают один на другой. Сверху ближе к замку бикса кладут еще один контрольный индикатор. Закрывают крышку бикса на замок. К ручке бикса крепят бирку – паспорт. Этап 3 – стерилизация. Перевязочный материал и белье стерилизуют автоклавированием при стандартных режимах. Этап 4 – хранение стерильного материала. Боковые отверстия простерилизованного бикса должны быть закрыты. Биксы со стерильным материалом хранятся отдельно от биксов с нестерильным. После стерилизации хранить не вскрытый бикс можно 3 суток, после вскрытия 1 сутки. Неиспользованные биксы подвергаются повторной стерилизации. ПРОВЕРКА КАЧЕСТВА СТЕРИЛИЗАЦИИ Контроль за стерильностью может проводиться прямым и непрямым (косвенным) способами. Прямой способ – бактериологический, проводится посев со стерильных предметов. Его производят следующим образом: в операционной вскрывается бикс, маленькими кусочками марли, увлажненной изотоническим раствором хлорида натрия, несколько раз проводят по белью, после чего их опускают в пробирку. Взятый таким образом материал направляют на бактериологическое исследование. Бактериологический контроль проводят один раз в 10 дней. Он является самым надежным методом контроля стерильности. Для непосредственного контроля стерильности материала применяются непрямые способы. Благодаря им можно оценить качество стерилизации каждого бикса. Непрямые методы основаны на закладывании в стерилизуемые биксы термоиндикаторов, которые показывают, прошел ли стерилизуемый материал определенный температурный режим. Для индикаторов используют вещества с определенной точкой плавления: бензойную кислоту (120°С), мочевина (132°С), тиомочевину (180°С). Их помещают в ампулы. Индикаторы закладывают вместе со стерилизуемыми предметами. Расплавление порошка и превращение его в сплошную массу свидетельствует, что температура стерилизации была равна точке плавления контрольного вещества или превышала ее.
Стерилизация
Стерилизация предусматривает в стерилизуемом объекте уничтожение всех вегетативных и споровых микроорганизмов, и проводят её различными способами: паром, сухим горячим воздухом, кипячением, фильтрацией и т. д. Выбор того или иного способа стерилизации определяется качеством и свойствами микрофлоры стерилизуемого объекта.
Подготовка и стерилизация лабораторной посуды.Перед стерилизацией лабораторную посуду моют и сушат. Пробирки, флаконы, бутыли, матрицы и колбы закрывают ватно-марлевыми пробками. Поверх пробок на каждый сосуд (кроме пробирок) надевают бумажные колпачки. Резиновые, корковые и стеклянные пробки стерилизуют в отдельном пакете, привязанном к горлышку посуды. Чашки Петри стерилизуют завернутыми в бумагу по 1— 10 штук. Пастеровские пипетки по 3—15 шт. заворачивают оберточную бумагу. В верхнюю часть каждой пипетки вкладывают кусочек ваты, предупреждающий попадание материала в рот. При завертывании пипеток нужно соблюдать большую осторожность, чтобы не обломать запаянные концы капилляров. Во время работы пипетки из пакета вынимают за верхний конец.
В верхнюю часть градуированных пипеток, как и в пастеровские пипетки, вставляют предохранительную вату и затем заворачивают в плотную бумагу, нарезанную предварительно полосками шириной 2—2,5 см и длиной 50—70 см. Полоску кладут на стол, левый конец ее загибают и завертывают им кончик пипетки, затем, вращая пипетку, навертывают на нее ленту бумаги. Для того чтобы бумага не разворачивалась, противоположный конец ее закручивают или приклеивают. На бумаге надписывают объем завернутой пипетки. При наличии пеналов градуированные пипетки стерилизуют в них.
Лабораторную посуду стерилизуют: а) сухим жаром при температуре 175°С 1 ч., б) в автоклаве при давлении 1 атм. в течение 20— 30 мин.
Стерилизация шприцев.Шприцы стерилизуют в разобранном виде: отдельно цилиндр и поршень в 2% растворе гидрокарбоната натрия 30 мин. При работе со спороносной микрофлорой стерилизацию производят в автоклаве при 132±2°С (давл. 2 атм.) в течение 20 мин, при 126±2°С (давл. 1,5 атм.)— 30 мин. Простерилизованный шприц собирают после того, как он остынет, в цилиндр вставляют поршень, надевают иглу, предварительно вынув из нее мандрен. Иглу, цилиндр и поршень берут пинцетом, который стерилизуют вместе со шприцем.
Стерилизация металлических инструментов.Металлические инструменты (ножницы, скальпели, пинцеты и пр.) стерилизуют в 2% растворе гидрокарбоната натрия, который предупреждает появление ржавчины и потерю остроты. Лезвия скальпелей и ножниц перед погружением в раствор рекомендуется обертывать ватой.
Стерилизация бактериальных петель.Бактериальные петли, сделанные из платиновой или нихромовой проволоки, стерилизуют в пламени спиртовой или газовой горелки. Такой способ стерилизации получил название прокаливания или фламбирования. Петлю в горизонтальном положении вносят в нижнюю, наиболее холодную, часть пламени горелки, чтобы не произошло разбрызгивания сжигаемого патогенного материала. После того как он сгорит, петлю переводят в вертикальное положение, накаливают докрасна вначале нижнюю, затем верхнюю часть проволоки и прожигают петледержатель. Прокаливание в целом занимает 5—7 секунд.
Подготовка к стерилизации и стерилизация бумаги, марли и ваты. Вату, марлю, фильтровальную бумагу стерилизуют в сухожаровой печи при температуре 160°С в течение часа от момента показания термометром данной температуры или в автоклаве при давлении 1 атм. в течение 30 мин.
Перед стерилизацией бумагу и марлю нарезают кусочками, а вату сворачивают в виде шариков или тампонов нужной величины. После этого каждый вид материала в отдельности по одной или несколько штук заворачивают в плотную бумагу. При разрыве пакета простерилизованный материал следует стерилизовать повторно, так как стерильность его нарушается.
Стерилизация перчаток и других резиновых изделий. Изделия из резины (перчатки, трубки и т. д.), загрязненные вегетативной формой микробов, стерилизуют кипячением в 2% растворе гидрокарбоната натрия или текучим паром в течение 30 мин; при загрязнении спороносной микрофлорой—в автоклаве при давлении 1,5—2 атм. в течение 30 или 20 мин. Резиновые перчатки перед стерилизацией внутри и снаружи пересыпают тальком для предохранения их от склеивания. Между перчатками прокладывают марлю. Каждую пару перчаток завертывают отдельно в марлю и в таком виде помещают в биксы.
Стерилизация
культур микробов.Пробирки и чашки,
содержащие культуры микробов, не нужные
для дальнейшей работы, складывают в
металлический бак, пломбируют крышку
и сдают на стерилизацию. Культуры
микробов, вегетативные формы, убивают
в автоклаве в течение 30 мин при давлении
1,5 атм. Сдача баков для стерилизации в
автоклавную производится специально
выделенным лицом под расписку. Режим
стерилизации регистрируется в
специальном журнале. ВИДЫ СТЕРИЛИЗАЦИИ.Стерилизация кипячениемпроизводят в стерилизаторе. В
стерилизатор наливают дистиллированную
воду, так как водопроводная образует
накипь. ( Стеклянные предметы погружают
в холодную, металлические предметы—в
горячую воду с добавлением гидрокарбоната
натрия). Стерилизуемые предметы кипятят
на слабом огне. Началом стерилизации
считается момент закипания воды в
стерилизаторе. По окончании кипячения
инструменты берут стерильным пинцетом,
который кипятят вместе с остальными
предметами. Стерилизация сухим
жаромпроизводится в печи Пастера.
Подготовленный к стерилизации
материал кладут на полки так, чтобы он
не соприкасался со стенками. Шкаф
закрывают и после этого включают
обогрев. Продолжительность стерилизации
при температуре 150°С 2 ч, при 165°С—1 ч,
при 180°С—40 мин, при 200°С—10—15 мин (при
170°С бумага и вата желтеют, а при более
высокой температуре обугливаются).
Началом стерилизации считается тот
момент, когда температура в печи
достигнет нужной высоты. По окончании
срока стерилизации печь выключают, но
дверцы шкафа не открывают до полного
охлаждения, так как холодный воздух,
поступающий внутрь шкафа, может вызвать
образование трещин на горячей посуде.Стерилизация паром под давлением производят в автоклаве. Автоклав
состоит из двух котлов, вставленных
один в другой, кожуха и крышки. Наружный
котел называют водопаровой камерой,
внутренний — стерилизационной
камерой. В водопаровом котле происходит
образование пара. Во внутренний котел
помещают стерилизуемый материал. В
верхней части стерилизационного котла
имеются небольшие отверстия, через
которые проходит пар из водопаровой
камеры. Крышка автоклава герметически
привинчивается к кожуху. Кроме
перечисленных основных частей, автоклав
имеет ряд деталей, регулирующих его
работу: манометр, водомерное стекло,
предохранительный клапан, выпускной,
воздушный и конденсационный краны.
Манометр служит для определения
давления, создающегося в стерилизованной
камере. Нормальное атмосферное
давление (760 мм рт. ст.) принимается за
нуль, поэтому в неработающем автоклаве
стрелка манометра стоит на нуле. Между
показаниями манометра и температурой
имеется определенная зависимость.
Красная черта на шкале манометра
определяет максимальное рабочее
давление, которое допускается в автоклаве.
Предохранительный клапан служит для
предохранения от чрезмерного повышения
давления. Его устанавливают на
заданное давление, т. е. давление, при
котором нужно производить стерилизацию,
при переходе стрелки манометра за черту
клапан автоклава автоматически
открывается и выпускает лишний пар,
замедляя тем самым дальнейший подъем
давления. На боковой стенке автоклава
имеется водомерное стекло, показывающее
уровень воды в водопаровом котле. На
трубке водомерного стекла нанесены две 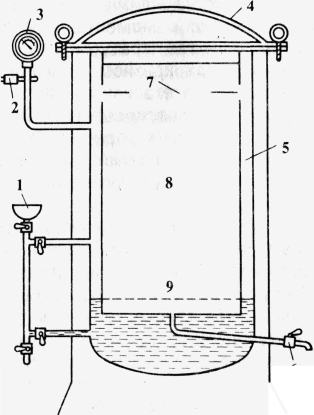
Рис. 9. Схема автоклава:
1 — воронка, через которую автоклав заправляют водой; 2 — предохранительный клапан; 3 — манометр; 4—крышка автоклава; 5 — водопаровая камера; 6 — кран для выпуска воздуха; 7— отверстие, через которое пар поступает в стерилизационную камеру; 8 -стерилизационная камера; 9 — подставка для размещения стерилизуемых материалов
горизонтальные черты — нижняя и верхняя, обозначающие соответственно допускаемый нижний и верхний уровень воды в водопаровой камере. Воздушный кран предназначен для удаления воздуха из стерилизационной и водопаровой камер в начале стерилизации, так как воздух, являясь плохим проводником тепла, нарушает режим стерилизации. На дне автоклава находится конденсационный кран для освобождения стерилизационной камеры от конденсата, образующегося в период нагревания стерилизуемого материала. Началом стерилизации считается тот момент, когда стрелка манометра показывает заданное давление. После этого интенсивность подогрева уменьшают, чтобы давление в автоклаве в течение нужного времени оставалось на одном уровне. По окончании времени стерилизации подогревание прекращают. Закрывают вентиль в трубопроводе, подающем пар в стерилизационную камеру, и открывают вентиль на конденсационной (нисходящей) трубе для снижения давления пара в камере. После падения стрелки манометра до нуля медленно ослабляют прижимные приспособления и открывают крышку (дверь) автоклава. Температура и продолжительность стерилизации определяются качеством стерилизуемого материала и свойствами тех микроорганизмов, которыми он заражен. Стерилизация текучим паромпроизводится в текучепаровом аппарате Коха или в автоклаве при незавинченной крышке и открытом выпускном кране. Аппарат Коха представляет собой металлический полый цилиндр с двойным дном. Пространство между верхней и нижней пластинками дна заполняют на 2/3 водой (для спуска оставшейся после стерилизации воды есть кран). Крышка аппарата имеет в центре отверстие для термометра и несколько небольших отверстий для выхода пара. Стерилизуемый материал загружают в камеру аппарата неплотно, чтобы обеспечить возможность наибольшего контакта его с паром. Началом стерилизации считается время с момента закипания воды и поступления пара в стерилизационную камеру. В текучепаровом аппарате стерилизуют главным образом питательные среды, свойства которых изменяются при температуре выше 100°С. Стерилизацию текучим паром следует проводить повторно, так как однократное прогревание при температуре 100°С не обеспечивает полного обеспложивания. Такой метод получил название дробной стерилизации: обработку стерилизуемого материала текучим паром проводят по 30 мин ежедневно в течение 3 дней. В промежутках между стерилизациями материал выдерживают при комнатной температуре для прорастания спор в вегетативные формы, которые погибают при последующих прогреваниях.
Тиндализация- дробная стерилизация с применением температуры ниже 100°С, предложенная Тиндалем. Прогревание стерилизуемого материала производят в водяной бане, снабженной терморегулятором, по часу при температуре 60—65°С в течение 5 дней или при 70— 80 C в течение 3 дней. В промежутках между прогреваниями обрабатываемый материал выдерживают при температуре 25°С для прорастания спор в вегетативные формы, которые погибают при последующих прогреваниях. Тиндализацией пользуются для обеспложивания питательных сред, содержащих белок.
Механическую стерилизацию с помощью бактериальных фильтровприменяют для освобождения жидкости от находящихся в ней бактерий, а также для отделения бактерий от вирусов, фагов и экзотоксинов. Вирусы бактериальными фильтрами не задерживаются, и поэтому ультрафильтрацию нельзя рассматривать как стерилизацию в принятом значении этого слова. Для изготовления фильтров применяют мелкопористые материалы (каолин, асбест, нитроцеллюлоза и др.), способные задерживать бактерий. Асбестовые фильтры (фильтры Зейтца) представляют собой асбестовые пластинки толщиной 3—5 мм и диаметром 35 и 140 мм для фильтрации малых и больших объемов жидкости. В нашей стране асбестовые фильтры, изготовляют двух марок: “Ф” (фильтрующие), задерживающие взвешенные частицы, но пропускающие бактерий, и “СФ” (стерилизующие), более плотные, задерживающие бактерий. Перед употреблением асбестовые фильтры монтируют в фильтровальные аппараты и вместе с ними стерилизуют в автоклаве. Асбестовые фильтры используются однократно. Мембранные ультрафильтры изготавливают из нитроклетчатки и представляют собой диски белого цвета. Непосредственно перед употреблением мембранные фильтры стерилизуют кипячением. Фильтры помещают в дистиллированную воду, подогретую до температуры 50— 60°С, чтобы предупредить их скручивание, кипятят на слабом огне в течение 30 мин, меняя 2—3 раза воду. Простерилизованные фильтры во избежание их повреждения вынимают из стерилизатора фламбированным и остуженным пинцетом с гладкими кончиками.
Рис.10. Установка для фильтрации жидкостей.
Для фильтрации жидкостей монтируют в специальные фильтровальные приборы: в частности Зейтца. Он состоит из 2-х частей: верхней, имеющей форму цилиндра или воронки, и нижней — опорной части аппарата, с так называемым фильтровальным столиком из металлической сетки или чистой керамической пластинки, на которую помещают мембранный или асбестовый фильтр. Опорная часть аппарата имеет форму воронки, суживающаяся часть которой в резиновой пробке горлышка колбы Бунзена. В рабочем состоянии верхнюю часть прибора фиксируют на нижней с помощью винтов. Перед началом фильтрации, места соединения различных частей установки, для создания герметичности, заливают парафином. Отводную трубку колбы присоединяют толстостенной резиновой трубкой к водоструйному, масляному или велосипедному насосу. После этого в цилиндр или воронку аппарата наливают фильтруемую жидкость и включают в действие насос, создающий вакуум в приёмном сосуде. В результате образующей разности давлений фильтруемая жидкость проходит через поры фильтра в приёмник. Микроорганизмы остаются на поверхности фильтра.
Стерилизация резиновых и пластмассовых инструментов.
Основной метод стерилизации резиновых изделий – автоклавирование. При многократной стерилизации резина теряет свои эластические свойства, трескается, что признано некоторым недостатком метода. Пластмассовые изделия разового использования, а также катетеры и зонды подвергают лучевой заводской стерилизации. Особо следует сказать о стерилизации перчаток. В последнее время наиболее часто используют одноразовые перчатки, подвергшиеся лучевой заводской стерилизации. При многократном использовании основным методом стерилизации становится автоклавирование в щадящем режиме: после предстерилизационной обработки перчатки высушивают, пересыпают тальком (предупреждает слипание), заворачивают в марлю, укладывают в бикс. Автоклавируют при 1,1 атм. в течение 30 – 40 мин, при 1,5 атм. – 15 – 20 мин. После надевания стерильных перчаток обычно их обрабатывают марлевым шариком со спиртом для снятия с поверхности талька или других веществ, препятствовавших слипанию резины. В экстренных случаях для стерилизации перчаток возможен следующий приём: хирург надевает перчатки и в течение 5 мин обрабатывает их тампоном, смоченным 96% этиловым спиртом.
Стерилизация оптических инструментов.
Основной метод стерилизации оптических инструментов, требующих щадящей обработки с исключением нагревания, — газовая стерилизация. Этим способом обрабатывают все инструменты для проведения лапароскопических и торакоскопических вмешательств, что связано со сложным их устройством. При стерилизации фиброгастроскопов, холедохоскопов, колоноскопов возможно применение и холодной стерилизации с использованием химических антисептиков. Следует особо отметить, что наилучшим способом профилактики контактной инфекции признано использование одноразового инструментария, подвергшегося лучевой заводской стерилизации!
Стерилизация перевязочного материала и белья.
Виды перевязочного материала и операционного белья.
К перевязочному материалу относят марлевые шарики, тампоны, салфетки, бинты, турунды, ватно-марлевые тампоны. Перевязочный материал обычно готовят непосредственно перед стерилизацией, используя специальные приёмы для предотвращения осыпания отдельных нитей марли. Для удобства подсчёта шарики укладывают по 50 – 100 штук в марлевые салфетки, салфетки и тампоны связывают по 10 штук. Перевязочный материал повторно не используют, после применения его уничтожают. К операционному белью относят хирургические халаты, простыни, полотенца, подкладные. Материалом для их изготовления служат хлопчатобумажные ткани. Операционное бельё многократного применения после использования проходит стирку, причём отдельно от других видов белья.
Стерилизация.
Перевязочный материал и бельё стерилизуют автоклавированием при стандартных режимах. Перед стерилизацией перевязочный материал и бельё укладывают в биксы. Существует три основных вида укладки бикса: универсальная, целенаправленная и видовая укладки.
Универсальная укладка.
Обычно используют при работе в перевязочной и при малых операциях. Бикс условно разделяют на секторы, каждый из них заполняют определённым видом перевязочного материала или белья: в один сектор помещают салфетки, в другой – шарики, в третий – тампоны и т. д.
Целенаправленная укладка.
Предназначена для выполнения типичных манипуляций, процедур и малых операций. Например, укладка для трахеостомии, катетеризации подключичной вены, перидуральной анестезии и пр. в бикс укладывают все инструменты, перевязочный материал и бельё, необходимые для осуществления процедур.
Видовая укладка.
Обычно используют в операционных, где необходимо большое количество стерильного материала. При этом в один бикс, например, укладывают хирургические халаты, в другой – простыни, в третий – салфетки и т. д. В небольшом количестве используют перевязочный материал в упаковках, прошедших лучевую стерилизацию. Существуют и специальные наборы операционного белья одноразового использования (халаты и простыни), изготовленные из синтетических тканей, также подвергшихся лучевой стерилизации.
Обработка рук хирурга.
Обработка (мытьё) рук хирурга – очень важная процедура. Существуют определённые правила мытья рук. Классические методы обработки рук Спасокукоцкого – Кочергина, Альфледа, Фюрбрингера и другие имеют лишь исторический интерес, их в настоящее время не применяют.
Стерилизация и дезинфекция изделий медицинского назначения
Чем отличается дезинфекция от стерилизации
Давайте сразу определимся с терминологией, после чего разница между стерилизацией и дезинфекцией вам будет понятна и без дальнейших объяснений.
Итак:
Дезинфекция – комплекс мероприятий, направленных на уничтожение вредных микроорганизмов возбудителей различных заболеваний на объектах внешней среды. Дезинфекция нужна не только в медицине, но и в обычной жизни. Например, дезинфекция помещения или инструмента для маникюра. После проведения этой процедуры, количество вредных микроорганизмов сокращается на 70-80%.
Стерилизация – абсолютное уничтожение всего живого в любом его проявлении (грибки, споры, бактерии) на поверхности объекта или внутри него, а также полное уничтожение всех продуктов их жизнедеятельности.
Думаем, вопрос, в чем отличия одного от другого теперь у вас не возникает. Поехали дальше.
Как проводится дезинфекция и стерилизация изделий медицинского назначения и кто этим занимается
Все операции по обеззараживанию медицинского инструментария ложатся на плечи медицинской сестры стерилизационного отделения. Это ответственный пост. Если по больнице растет количество внутрибольничных инфекций (основной бич наших клиник), то, скорее всего, медсестры стерилизационного отделения со свой ролью не справляются.

Сам процесс стерилизации состоит из 3 этапов:
- дезинфекция;
- предстерилизационная обработка;
- стерилизация.
Расскажем о каждом из них подробнее.
Все изделия медицинского назначения делятся в первую очередь на изделия однократного применения и многократного. С первыми все более-менее понятно – использовал, продезинфицировал и отправил в утилизацию (не просто в мусорку, а именно в утилизацию). С изделиями многократного применения чуть сложнее.
После их применения они делятся на 3 группы:
- Критический инструмент. Это приспособления, с помощью которых делали операции, то есть они соприкасались раневой поверхностью или на них есть следы крови или препаратов для инъекций. К этой группе можно отнести скальпели, шприцы, иглы для инъекций и хирургические.
- Условно-критический инструмент. Следов крови на них быть не должно, но это инструменты, которые соприкасались со слизистыми оболочками и могли их поранить. К таким инструментам можно отнести различные шпатели (Скажите «Ааааа…» ), мочевые катетеры, зонды, эндоскопы и тд.
- Некритичный инструмент. Приспособления которые соприкасались с неповрежденной кожей. Это могут быть манжеты тонометров, судна, грелки.
Обязательной стерилизации подвергаются инструменты первых двух групп, для некритичного медицинского инструмента достаточно дезинфекции.
Дезинфекция изделий медицинского назначения
Весь использованный инструментарий погружают в емкость с раствором 3% хлорамина или 0,5% раствор дезоксона и тщательно промывают. Затем раствор меняют на чистый и дополнительно выдерживают в нём в течение часа.
Предстерилизационная обработка
Проводится после дезинфекции для удаления любых загрязнений оставшихся после 1 этапа.
Весь продезинфицированный инструмент замачивается в специальном растворе на 15 минут. Затем тщательно промывается с помощью ёршиков и одноразовыми ватно-марлевыми тампонами. Промывается еще раз под чистой проточной водой для удаления остатков дезинфицирующего раствора. Но и это еще не все. Весь инструментарий еще раз хорошенько промывается уже в дистиллированной воде (допускается кипячение в течение 5 минут) и отправляется на сушку в сухожаровой шкаф при температуре 80-85 °C
Качество обработки проверяется с помощью проб:
- амидопириновая, бензидиновая и ортотолуидиновая проба – определяют наличие остатков крови;
- фенолфталеиновая проба – для определения щелочных остатков моющих средств.
Если пробы показывают положительный результат – весь инструмент отправляется на повторную обработку.
Стерилизация медицинских инструментов
Для разных инструментов применяются разные способы стерилизации в зависимости от материала изготовления.
Металлические предметы стерилизуют в сухожаровом шкафу или автоклаве.
Автоклав (греч. авто — сам + лат. clavis — запор, задвижка) — герметичный аппарат для различных операций, которые требуют нагрева под давлением выше атмосферного.
Википедия
Для скальпелей и других режущих предметов применяют химическую стерилизацию. Сложные медицинские приборы, которые имеют оптические компоненты обрабатываются в газовых стерилизаторах.
Стерилизация резиновых изделий
В большинстве случаев резиновые медицинские изделия подвергаются обработке в автоклаве. Это не самый оптимальный метод, поскольку при многократной обработке резина теряет свои свойства и начинает трескаться. Что касается стерилизации резиновых перчаток (хирургических например), то в последнее время в больницах стараются использовать одноразовые, которые подвергались лучевой обработке еще на заводе. Однако, если перчатки используются многократно, то обрабатываются вот таким образом:
Сухие резиновые перчатки стерилизуются в автоклаве. Чтобы они не слипались, их предварительно посыпают тальком внутри и снаружи. Затем каждую пару перчаток заворачивают отдельно в марлю или бумагу и только после этого помещают в бикс. Режим стерилизации при температуре пара 120 гр. С, давлении 1,1 атм. — 45 минут.
Бикс (от нем. buchse — «банка», «жестянка»), металлический стерилизационный контейнер , для стерилизации материалов и инструментов медицинского назначения в паровых стерилизаторах (автоклавах) и хранения их в операционных и перевязочных.
Википедия
Дезинфекция одноразовых инструментов
Все одноразовые инструменты (иглы, шприцы, капельницы и тд) подлежат обязательной дезинфекции и утилизации.
Механическая дезинфекция одноразовых шприцев алгоритм
В первую очередь использованный одноразовый шприц промывается в проточной воде, что бы смыть следы крови и лекарственных препаратов. Затем их дезинфицируют с помощью кипячения или помещают в автоклав. Кроме этого, шприцы можно обеззараживать в специальной СВЧ-установке при температуре 140 градусов (не путайте с домашней микроволновкой). Эти методы можно отнести к механической дезинфекции.
Химическая
Применяется для дезинфекции использованных одноразовых игл и шприцев методом погружения их в контейнер с обеззараживающим раствором. Перед этим саму иглу следует отделить от шприца с помощью специального устройства – иглосъемника. Это пластиковый контейнер с приспособлением для фиксации и отсоединения иглы после укола.
Если шприц с несъемной (интегрированной иглой) поможет другое устройство – иглоотсекатель. В процедурных кабинетах обычно есть и то и другое.
Если вдруг подобных устройств нет (не важно по какой причине), снимать иглу руками можно только после проведения дезинфекции инструмента в неразобранном состоянии.
Если сразу после использования шприца работы по обеззараживанию провести нельзя, использованные шприцы складывают в специальные контейнеры, где они хранятся до поступления на дезинфекцию.
Утилизация использованных одноразовых шприцев и игл
Самые распространенные способы утилизации одноразового медицинского инструмента:
- сжигание;
- захоронение на полигонах ТБО;
- вторичная переработка материалов.
С помощью небольших переносных устройств –деструкторов, иглы можно уничтожать сразу после инъекции прямо в больнице.
