Стерилизация (микробиология) — Википедия
Материал из Википедии — свободной энциклопедии
Стерилизация методом кипяченияСтерилиза́ция (иногда деконтаминация) — освобождение какого-либо предмета или материала от всех видов микроорганизмов (включая бактерии и их споры, грибы, вирусы и прионы), либо их уничтожение. Осуществляется термическим, химическим, радиационным, фильтрационным методами.
Пищевые продукты[править | править код]
С давних времен частичная стерилизация пищи обеспечивалась за счет тщательной тепловой обработки во время приготовления. Нагревание пищи и воды позволяло снизить число случаев инфекционных заболеваний, увеличивая продолжительность жизни и трудоспособного возраста. Консервирование продуктов в герметичной упаковке стало логическим продолжением этого подхода к сохранению пищи.
Медицина[править | править код]
В медицине под стерилизацией понимается микробная деконтаминация неживых объектов. Принцип асептики предполагает исключение контакта пациента с поверхностями контаминированными условно-патогенной или даже патогенной микробиотой. С этой целью стерилизовались скальпели, иглы и другой хирургический инструмент. Также стерилизация играет важную роль в производстве парентеральных препаратов.
Нагревание медицинских инструментов было известно ещё в Древнем Риме, но было забыто в Средние века, что привело к резкому росту числа осложнений и летальности после хирургических операций.
- Термическая: паровая и воздушная (сухожаровая)
- Химическая: газовая или химическими растворами (стерилянтами)
- Плазменная (плазмой перекиси водорода)
- Радиационная стерилизация — применяется в промышленном варианте
- Метод мембранных фильтров — применяется для получения небольшого количества стерильных растворов, качество которых может резко ухудшиться при действии других методов стерилизации (бактериофаг, селективные питательные среды, антибиотики)[1]
Термические методы стерилизации[править | править код]
Преимущества термических методов стерилизации:
- Надёжность
- Отсутствие необходимости удаления стерилянтов с предметов медицинского назначения
- Удобство работы персонала
- Стерилизация проводится в упаковках, что позволяет сохранить стерильность некоторый период времени.
Паровая стерилизация[править | править код]
Осуществляется подачей насыщенного водяного пара под давлением в паровых стерилизаторах (автоклавах).
Паровая стерилизация под давлением считается наиболее эффективным методом, так как чем выше давление, тем выше температура пара, стерилизующего материал; бактерицидные свойства пара выше, чем воздуха, поэтому для стерилизации применяют пересыщенный пар.
Паровой стерилизации подвергают изделия из текстиля (бельё, вату, бинты, шовный материал), из резины, стекла, некоторых полимерных материалов, питательные среды, лекарственные препараты.
| Температура | Давление | Время | Описание |
|---|---|---|---|
| 132 °C | 2,1 атм | 3,5 мин | Основной режим. Стерилизуют все изделия (стекло, металл, текстиль, кроме резиновых) |
| 132 °C | 2,1 атм | 20 мин | режим «прионовой стерилизации» |
| 120 °C | 1,1 атм | 45 мин | щадящий режим (стекло, металл, резиновые изделия, полимерные изделия — согласно паспорту; текстиль) |
При паровой стерилизации используют следующие упаковочные материалы:
- Стерилизационная коробка (бикс) простая. Срок хранения 3 суток после стерилизации.
- Стерилизационная коробка (бикс) с фильтром. Срок хранения 20 суток после стерилизации.
- Крафт-пакеты со скрепками. Срок хранения — трое суток после стерилизации.
- Крафт-пакеты заклеивающиеся. Срок хранения — 50 суток после стерилизации.
- Ткань (бязь — КРОМЕ МАРЛИ). Срок хранения — трое суток после стерилизации.
- Комбинированные упаковки (прозрачная синтетическая плёнка + бумага). Срок хранения от 180 суток до 720 суток.
Тиндализация[править | править код]
Тиндализацию применяют для стерилизации растворов, неустойчивых к действию высокой температуры. Она состоит в неоднократном нагревании до температуры 70—100°С с промежутками в 24 ч.
Химические методы стерилизации[править | править код]
Используются при обработке приборов, аппаратов, сложных оптических систем, крупногабаритных изделий или изделий из титана, полимерных смол, резин.
Для газовой (холодной) стерилизации[2] используют окись этилена или герметичные контейнеры с парами окиси этилена, формальдегида или специализированными многокомпонентными системами.
Для химической стерилизации растворами применяются основных четыре группы веществ:
Концентрации и время стерилизации зависит от используемого антисептика или дезинфектанта.
Стерилизация ионизирующим излучением[править | править код]
- радиационный метод или лучевую стерилизацию γ-лучами применяют в специальных установках при промышленной стерилизации однократного применения — полимерных шприцев, систем переливания крови, чашек Петри, пипеток и других хрупких и термолабильных изделий.
- Ряд лет в фармтехнологии для стерилизации используется ультрафиолетовое (УФ) (длина волны 253,7 нм). Источники УФ-излучения — ртутные кварцевые лампы. Их мощное бактериостатическое действие основано на совпадении спектра испускания лампы и спектра поглощения ДНК микроорганизмов, что может являться причиной их гибели при длительной обработке излучением кварцевых ламп. При недостаточно мощном действии УФ в прокариотической клетке активизируются процессы световой и темновой репарации и клетка может восстановиться. Метод применяется для стерилизации воздуха приточно-вытяжной вентиляции, оборудования в боксах, также для стерилизации дистиллированной воды.[3]
Виды стерилизации
Стерилизация кипячением. Стерилизацию кипячением производят в стерилизаторе. В стерилизатор наливают дистиллированную воду, так как водопроводная образует накипь. (Стеклянные предметы погружают в холодную, металлические предметы—в горячую воду с добавлением гидрокарбоната натрия). Стерилизуемые предметы кипятят на слабом огне 30-60 минут. Началом стерилизации считается момент закипания воды в стерилизаторе. По окончании кипячения инструменты берут стерильным пинцетом, который кипятят вместе с остальными предметами.Стерилизация сухим жаром. Стерилизация сухим жаром производится в печи Пастера. Подготовленный к стерилизации материал кладут на полки так, чтобы он не соприкасался со стенками. Шкаф закрывают и после этого включают обогрев. Продолжительность стерилизации при температуре 150°С 2 ч, при 165°С – 1 ч, при 180°С – 40 мин, при 200°С – 10-15 мин (при 170°С бумага и вата желтеют, а при более высокой температуре обугливаются). Началом стерилизации считается тот момент, когда температура в печи достигнет нужной высоты. По окончании срока стерилизации печь выключают, но дверцы шкафа не открывают до полного охлаждения, так как холодный воздух, поступающий внутрь шкафа, может вызвать образование трещин на горячей посуде.
Стерилизация паром под давлением. Стерилизацию паром под давлением производят в автоклаве. Автоклав состоит из двух котлов, вставленных один в другой, кожуха и крышки. Наружный котел называют водопаровой камерой, внутренний — стерилизационной камерой. В водопаровом котле происходит образование пара. Во внутренний котел помещают стерилизуемый материал. В верхней части стерилизационного котла имеются небольшие отверстия, через которые проходит пар из водопаровой камеры. Крышка автоклава герметически привинчивается к кожуху. Кроме перечисленных основных частей, автоклав имеет ряд деталей, регулирующих его работу: манометр, водомерное стекло, предохранительный клапан, выпускной, воздушный и конденсационный краны. Манометр служит для определения давления, создающегося в стерилизационной камере. Нормальное атмосферное давление (760 мм рт. ст.) принимается за нуль, поэтому в неработающем автоклаве стрелка манометра стоит на нуле. Между показаниями манометра и температурой имеется определенная зависимость (табл. ).
Таблица
Соотношения показаний манометра и температуры кипения воды
Показания манометра, атм. | t кипения воды,°C | Показания манометра, атм. | t кипения воды,°C |
0,0 | 100° | 0,8 | 117° |
0,2 | 105° | 0,9 | 119° |
0,4 | 110° | 1,0 | 121° |
0,5 | 112° | 1,5 | 127° |
0,6 | 114° | 2,0 | 134° |
0,7 | 116° |
Красная черта на шкале манометра определяет максимальное рабочее давление, которое допускается в автоклаве. Предохранительный клапан служит для предохранения от чрезмерного повышения давления. Его устанавливают на заданное давление, то есть, давление, при котором нужно производить стерилизацию, при переходе стрелки манометра за черту клапан автоклава автоматически открывается и выпускает лишний пар, замедляя тем самым дальнейший подъем давления.
На боковой стенке автоклава имеется водомерное стекло, показывающее уровень воды в водопаровом котле. На трубке водомерного стекла нанесены две горизонтальные черты — нижняя и верхняя, обозначающие соответственно допускаемый нижний и верхний уровень воды в водопаровой камере. Воздушный кран предназначен для удаления воздуха из стерилизационной и водопаровой камер в начале стерилизации, так как воздух, являясь плохим проводником тепла, нарушает режим стерилизации. На дне автоклава находится конденсационный кран для освобождения стерилизационной камеры от конденсата, образующегося в период нагревания стерилизуемого материала.
Правила работы с автоклавом. Перед началом работы осматривают автоклав и контрольно-измерительную аппаратуру. В автоклавах с автоматическим регулированием пара на электровакуумном манометре водопаровой камеры стрелки устанавливают в соответствии с режимом стерилизации: нижнюю стрелку ставят на 0,1 атм. ниже, верхнюю—на 0,1 атм. выше рабочего давления, водопаровую камеру заполняют водой до верхней отметки мерного стекла. В период заполнения водой вентиль на трубе, по которой пар поступает в камеру, держат открытым для свободного выхода воздуха из котла. Стерилизационную камеру автоклава загружают стерилизуемым материалом. После этого крышку (или дверцу) автоклава закрывают, плотно закрепляя центральным затвором или болтами; чтобы избежать перекоса, болты завинчивают крест-накрест (по диаметру). Затем включают источник подогрева (электрический ток, пар), закрывая вентиль на трубе, соединяющей источник пара со стерилизационной камерой. С началом парообразования и создания давления в водопаровой камере производят продувку (удаление воздуха из стерилизационного котла). Способ удаления воздуха определяется конструкцией автоклава. Вначале воздух выходит отдельными порциями, затем появляется ровная непрерывная струя пара, указывающая, что из стерилизационной камеры воздух полностью вытеснен. После удаления воздуха кран закрывают, и в стерилизационной камере начинается постепенное повышение давления.
Началом стерилизации считается тот момент, когда стрелка манометра показывает заданное давление. После этого интенсивность подогрева уменьшают, чтобы давление в автоклаве в течение нужного времени оставалось на одном уровне. По окончании времени стерилизации подогревание прекращают. Закрывают вентиль в трубопроводе, подающем пар в стерилизационную камеру, и открывают вентиль на конденсационной (нисходящей) трубе для снижения давления пара в камере. После падения стрелки манометра до нуля медленно ослабляют прижимные приспособления и открывают крышку автоклава.
Температура и продолжительность стерилизации определяются качеством стерилизуемого материала и свойствами тех микроорганизмов, которыми он заражен.
Контроль температуры в стерилизационной камере осуществляется периодически с помощью бактериологических тестов. Биотесты изготовляются бактериологическими лабораториями ЦСЭН. В случае непрохождения данных тестов производят проверку технического состояния автоклава.
Стерилизация текучим паром. Стерилизация текучим паром производится в текучепаровом аппарате Коха или в автоклаве при незавинченной крышке и открытом выпускном кране. Аппарат Коха представляет собой металлический полый цилиндр с двойным дном. Пространство между верхней и нижней пластинками дна заполняют на 2/3 водой (для спуска оставшейся после стерилизации воды есть кран). Крышка аппарата имеет в центре отверстие для термометра и несколько небольших отверстий для выхода пара. Стерилизуемый материал загружают в камеру аппарата неплотно, чтобы обеспечить возможность наибольшего контакта его с паром. Началом стерилизации считается время с момента закипания воды и поступления пара в стерилизационную камеру. В текучепаровом аппарате стерилизуют, главным образом, питательные среды, свойства которых изменяются при температуре выше 100°С. Стерилизацию текучим паром следует проводить повторно, так как однократное прогревание при температуре 100°С не обеспечивает полного обеззараживания. Такой метод получил название дробной стерилизации: обработку стерилизуемого материала текучим паром проводят по 30 минут ежедневно в течение 3 дней. В промежутках между стерилизациями материал выдерживают при комнатной температуре для прорастания спор в вегетативные формы, которые погибают при последующих прогреваниях.
Тиндализация. Тиндализация—дробная стерилизация с применением температуры ниже 100°С, предложенная Тиндалем. Прогревание стерилизуемoгo материала производят в водяной бане, снабженной терморегулятором, по часу при температуре 60—65°С в течение 5 дней или при 70— 80°C в течение 3 дней. В промежутках между прогреваниями обрабатываемый материал выдерживают при температуре 25°С для прорастания спор в вегетативные формы, которые погибают при последующих прогреваниях. Тиндализацией пользуются для обеспложивания питательных сред, содержащих белок.
Механическая стерилизация с помощью бактериальных ультрафильтров. Бактериальные фильтры применяют для освобождения жидкости от находящихся в ней бактерий, а также для отделения бактерий от вирусов, фагов и экзотоксинов. Вирусы бактериальными фильтрами не задерживаются, и поэтому ультрафильтрацию нельзя рассматривать как стерилизацию в принятом значении этого слова. Для изготовления ультрафильтров применяют мелкопористые материалы (каолин, асбест, нитроцеллюлоза и др.), способные задерживать бактерии.
Асбестовые фильтры (фильтры Зейтца) представляют собой асбестовые пластинки толщиной 3—5 мм и диаметром 35 и 140 мм для фильтрации малых и больших объемов жидкости. В нашей стране асбестовые фильтры, изготовляют двух марок: «Ф» (фильтрующие), задерживающие взвешенные частицы, но пропускающие бактерии, и «СФ» (стерилизующие), более плотные, задерживающие бактерии. Перед употреблением асбестовые фильтры монтируют в фильтровальные аппараты и вместе с ними стерилизуют в автоклаве. Асбестовые фильтры используются однократно. Мембранные ультрафильтры изготавливаются из нитроцеллюлозы и представляют собой диски белого цвета диаметром 35 мм и толщиной 0,1 мм.
Бактериальные фильтры различаются по величине пор и обозначаются порядковыми номерами (табл. ).
Таблица
Бактериальные фильтры
No фильтра | Средний диаметр пор, мкм |
1 | 0,3 |
2 | 0,5 |
3 | 0,7 |
4 | 0.9 |
5 | 1,2 |
Непосредственно перед употреблением мембранные фильтры стерилизуют кипячением. Фильтры помещают в дистиллированную воду, подогретую до температуры 50— 60°С, чтобы предупредить их скручивание, кипятят на слабом огне в течение 30 минут, меняя 2—3 раза воду. Простерилизованные фильтры во избежание их повреждения вынимают из стерилизатора фламбированным и остуженным пинцетом с гладкими кончиками.
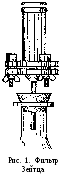
Для фильтрации жидкостей бактериальные фильтры монтируют в специальные фильтровальные приборы, в частности, в фильтр Зейтца.
Он состоит из 2-х частей: верхней, имеющей форму цилиндра или воронки, и нижней—опорной части аппарата, с так называемым фильтровальным столиком из металлической сетки или чистой керамической пластинки, на которую помещают мембранный или асбестовый фильтр. Опорная часть аппарата имеет форму воронки, суживающаяся часть которой находится в резиновой пробке горлышка колбы Бунзена. В рабочем состоянии верхнюю часть прибора фиксируют на нижней с помощью винтов. Перед началом фильтрации места соединения различных частей установки для создания герметичности заливают парафином. Отводную трубку колбы присоединяют толстостенной резиновой трубкой к водоструйному, масляному или велосипедному нacocy. После этого в цилиндр или воронку аппарата наливают фильтруемую жидкость и включают насос, создающий вакуум в приемном сосуде. В результате образующейся разности давлений фильтруемая жидкость проходит через поры фильтра в приемник. Микроорганизмы остаются на поверхности фильтра.
Методы стерилизации
Виды стерилизации | Методы стерилизации | Действующий агент |
Физический | паровой (автоклавирование) | пар под избыточным давлением (120 0С, давление 1,1 атм) (132 0С, давление 2,0 атм) |
воздушный | сухой воздух при 180 °С | |
гласперленовый | нагретые стеклянные шарики при 190-240 0С | |
инфракрасный | инфракрасное излучение при 200±3 0С | |
лучевой | ионизирующее излучение 2- 2,5 Мрад | |
ультразвуковой | механические колебания с частотой от 2х104 до 2х10 8 в сек | |
Химический | жидкостной | растворы химических соединений (альдегид-, кислород-, хлорсодержащих) |
газовый | окись этилена в смеси с углекислым газом, бромистым метилом и др. | |
плазменный | пары 20 % пероксида водорода |
Паровой метод стерилизации (автоклавирование)
Впервые стерилизация паром под повышенным давлением в автоклаве осуществлена в 1884 году Л.Л. Гендейрейхом.
При этом способе стерилизации действующим агентом является горячий пар. В автоклаве возможно нагревание воды под повышенным давлением, что приводит к по-вышению точки кипения воды и соответственно пара до 132 0С (при давлении 2 атм.).
Паровым методом стерилизуют общие хирургические и специальные инструменты, детали приборов и аппаратов из коррозионно-стойких металлов, стекла, шприцы с пометкой 200 0С, хирургическое белье, перевязочный и шовный материал, изделия из резин (перчатки, трубки, катетеры, зонды и т.д.), латекса, отдельных видов пластмасс.
Табл. 3.
Режимы стерилизации некоторых медицинских инструментов
Способ стерилизации | Температура, 0С | Давление, атм. | Время стерилизации, мин | Вид изделий, рекомендуемых к стерилизации данным методом |
Водяным насыщенным паром под избыточным давлением (автоклав) | 132 | 2 | 20 | Изделия из коррозионно-стойких металлов, стекла, изделия из текстильных материалов, резин, лигатурный шовный материал |
120 | 1,1 | 45 | Изделия из резин, латекса, отдельных видов пластмасс (полиэтилен высокой плотности, ПВХ-пластикаты), лигатурный шовный материал | |
Сухим горячим воздухом (суховоздушный стерилизатор) | 180 | 1 | 60 | Изделия из металлов, стекла и резин на основе силиконового каучука |
Материал для стерилизации помещают в специальные биксы Шиммельбуша, пергамент, бумагу мешочную, упаковочную, крепированную, стерилизационные коробки с фильтром.
Одним из основных условий проведения качественной стерилизации является загрузка автоклава в точном соответствии с рекомендациями производителя. Это означает правильное расположение и количество загружаемых предметов. Водяной пар должен свободно циркулировать, а конденсат своевременно выводиться. При загрузке автоклава обращают внимание на то, чтобы тяжелые инструменты располагались на нижних поддонах, а легкие – на верхних.
Изделия загружают в таком количестве, которое допускает свободную подачу воздуха к стерилизуемым изделиям. Не допускается перекрывать продувочные окна и решетки вентиляции. Загрузку и выгрузку изделий проводят при температуре не выше 40-50°С.
Срок хранения простерилизованных изделий: в биксах без фильтра, в двойной мягкой упаковке – 3 суток; в пергаменте, бумаге мешочной непропитанной, мешочной влагопрочной, бумаге упаковочной высокопрочной, бумаге крепированной, стерилизационной коробке с фильтром – 20 суток.
Воздушный метод стерилизации
При воздушном методе стерилизации стерилизующим средством является сухой горячий воздух температурой 1600С и 1800С; стерилизацию осуществляют в суховоздушных стерилизаторах.
Воздушным методом стерилизуют хирургические, гинекологические, стоматологические инструменты, детали приборов и аппаратов, в том числе изготовленные из коррозионно-нестойких металлов, шприцы с пометкой 200 0С, инъекционные иглы, изделия из силиконовой резины.
Перед стерилизацией воздушным методом изделия после предстерилизационной очистки обязательно высушивают в сушильном шкафу при температуре 85 °C до исчезновения видимой влаги.
Качество стерилизации воздушным методом зависит от равномерности распределения горячего воздуха в стерилизационной камере, что достигается правильной загрузкой стерилизатора. Изделия загружают в таком количестве, которое допускает свободную подачу воздуха к стерилизуемому изделию.
Изделия стерилизуют завернутыми в стерилизационные упаковочные материалы. Шприцы стерилизуют в разобранном виде.
Во время стерилизации металлических инструментов без упаковки их располагают так, чтобы они не касались друг друга.
Стерилизация в среде нагретых стеклянных шариков (гласперленовая)
В стерилизаторах, стерилизующим средством в которых является среда нагретых стеклянных шариков (гласперленовые шариковые стерилизаторы), стерилизуют изделия, применяемые в стоматологии (боры зубные, головки алмазные, дрильборы, а также рабочие части гладилок, экскаваторов, зондов и др.). При стерилизации стеклянные шарики нагреваются до температуры 190-240 0С. Стерилизация проводится в течение 5 — 15 секунд.
Недостатком метода является возможность стерилизации только мелких инструментов. У более крупных инструментов для такой обработки доступна только рабочая часть. А полная их стерилизация даже при увеличении экспозиции не удается. Проблемы возникают и со средствами контроля работы этих стерилизаторов.
Инфракрасная стерилизация
Существуют стерилизаторы, в которых используется метод, основанный на применении кратковременного импульсного инфракрасного излучения, создающего в рабочей камере температуру 200±30С. Время инфракрасной стерилизации инструментария в неупакованном виде составляет от 10 до 25 минут. Недостатками данного метода стерилизации являются отсутствие упаковки инструментов, повреждающее воздействие на полимерные материалы и резину, отсутствие контролирующих индикаторов.
Лучевая стерилизация.
Используют гамма и бета — частицы и относительно тяжелые нейтроны, протоны и т. д. Разница вызываемых ими биологических изменений почти незаметна. Радиоактивное излучение, проходя через среду, вызывает ионизацию последней, в связи с чем его называют ионизирующим излучением. Бактерицидный эффект ионизирующего излучения обусловлен воздействием на метаболические процессы бактериальной клетки. Наибольшее применение получила стерилизация гамма-лучами. Используются изотопы Co60 и Cs138. Доза проникающей радиации значительна и составляет 2-2,5 Мрад. В связи с этим лучевая стерилизация в стационарах не производится и применяется в промышленных условиях.
Метод применяется для стерилизации одноразовых инструментов (шприцы, шовный материал, катетеры, зонды, системы для переливания крови, перчатки и др.). При сохранении целостности упаковки стерильные свойства предметов сохраняются в течение 5 лет.
Ультразвуковая стерилизация
Механические колебания с частотой от 2х104 до 2х10 8 колебаний в 1 секунду не воспринимаются ухом человека и называются ультразвуком. Для искусственного получения ультразвука служат специальные приборы. Источником ультразвука являются кристаллы кварца, турмалина, обладающие пьезоэлектрическими свойствами. Пьезоэлектрический эффект обусловлен явлением электрической поляризации кристаллов.
При воздействии на ткани ультразвуковой волны происходит образование микроскопических полостей, которые быстро закрываются под воздействием последующего сжатия. Такое явление называется кавитацией. Ультразвуковая кавитация приводит к образованию свободных радикалов, диссоциации молекул воды на ионы Н+ и ОН—, что приводит к нарушению окислительно-восстановительных процессов в микробной клетке.
Ультразвуковые волны используются для стерилизации инструментов, подготовки рук медицинского персонала к операции. Для этого руки (инструменты) погружают в специальную ванну с дезинфицирующим раствором, через который пропускают ультразвуковые волны.
Стерилизация растворами химических средств
Стерилизация изделий растворами химических средств является вспомогательным методом, поскольку изделия нельзя простерилизовать в упаковке, а по окончании стерилизации их необходимо промыть стерильной жидкостью (питьевая вода, 0,9 % раствор натрия хлорида), что при нарушении правил асептики может привести к вторичному обсеменению простерилизованных изделий микроорганизмами.
Данный метод следует применять для стерилизации изделий, в конструкцию которых входят термолабильные материалы, то есть в тех случаях, когда особенности материалов изделий не позволяют использовать другие официально рекомендуемые методы стерилизации.
Для стерилизации растворами химических средств используют такие средства, как первомур, перекись водорода, дезоксон — 1, 4, стераниос 20%, сайдекс, лизоформин-3000, глютарал и др.
При стерилизации растворами химических средств используют стерильные емкости из стекла, металлов, термостойких пластмасс, выдерживающих стерилизацию паровым методом, или покрытые эмалью (эмаль без повреждений).
Температура растворов, за исключением специальных режимов применения перекиси водорода и средства Лизоформин 3000, должна составлять не менее 200С для альдегидсодержащих средств и не менее 180С – для остальных средств.
Стерилизацию проводят при полном погружении изделий в раствор, свободно их раскладывая. При большой длине изделия его укладывают по спирали. Разъемные изделия стерилизуют в разобранном виде. Каналы и полости заполняют раствором.
После стерилизации все манипуляции проводят, строго соблюдая правила асептики. Изделия извлекают из раствора с помощью стерильных пинцетов (корнцангов), удаляют раствор из каналов и полостей, а затем промывают в стерильной жидкости, налитой в стерильные емкости, согласно рекомендациям методического документа по применению конкретного средства. При каждом переносе из одной емкости в другую освобождение каналов и полостей и их заполнение свежей жидкостью осуществляют с помощью стерильного шприца, пипетки или иного приспособления.
Промытые стерильные изделия после удаления остатков жидкости из каналов и полостей используют сразу по назначению или помешают (с помощью стерильных пинцетов, корнцангов) на хранение в стерильную стерилизационную коробку, выложенную стерильной простыней, на срок не более 3 суток.
Газовая стерилизация
Для газового метода стерилизации используют смесь ОБ (смесь окиси этилена и бромистого метила в весовом соотношении 1:2,5 соответственно), окись этилена, пары раствора формальдегида в этиловом спирте, а также озон (табл. 4) .
Стерилизацию смесью ОБ и окисью этилена проводят при комнатной температуре (не менее 180С), при температуре 350С и 550С, парами раствора формальдегида в этиловом спирте при температуре 800С.
Табл. 4.
Стерилизация
Стерилизация – удаление или уничтожение всех живых микроорганизмов (вегетативных и споровых форм) внутри или на поверхности предметов.
Стерилизация проводится различными методами: физическими, химическими, механическими.
Основные требования, предъявляемые к процессу стерилизации, отражены в отраслевом стандарте 42-21-2-82 «Стерилизация и дезинфекция изделий медицинского назначения. Методы, средства, режимы».
Физические методы. Самым распространенным методом стерилизации является воздействие высокой температуры. При температуре, приближающейся к 1000С, происходит гибель большинства патогенных бактерий и вирусов. Споры почвенных бактерий-термофилов погибают при кипячении в течение 8,5 часов. Микроорганизмы, попавшие в глубинные слои земли, или покрытые свернувшейся кровью, оказываются защищенными от воздействия высокой температуры и сохраняют свою жизнеспособность.
При стерилизации физическими методами применяют действие высоких температур, давления, ультрафиолетового облучения и др.
Наиболее простой, но надежный вид стерилизации – прокаливание. Его применяют при поверхностной стерилизации негорючих и теплоустойчивых предметов непосредственно перед их использованием.
Другим простым и легко доступным методом стерилизации считается кипячение. Этот процесс проводят в стерилизаторе – металлической коробке прямоугольной формы с двумя ручками и плотно закрывающейся крышкой. Внутри расположена вынимающаяся металлическая сетка с ручками по бокам, на которую кладут стерилизуемый инструмент. Основной недостаток метода заключается в том, что он не уничтожает споры, а только вегетативные формы.
При паровой стерилизации необходимо выполнение определенных условий, которые гарантируют ее эффективность и сохранение стерильности изделий в течение определенного срока. Прежде всего, стерилизация инструментов, операционного белья, перевязочного материала должна проводиться в упаковке. С этой целью используют: стерилизационные коробки (биксы), двойную мягкую упаковку из бязи, пергамент, влагопрочную бумагу (крафт-бумага), полиэтилен высокой плотности.
Обязательное требование к упаковке – герметичность. Сроки сохранения стерильности зависят от вида упаковки и составляют трое суток для изделий простерилизованных в коробках без фильтров, в двойной мягкой упаковке из бязи, бумаги мешочной влагопрочной. В стерилизационных коробках с фильтрами стерильность изделий сохраняется в течение года.
Стерилизация сухим жаром. Процесс стерилизации сухим жаром проводят в сухожаровом шкафу (в печи Пастера и др.) – металлическом шкафу с двойными стенками. В корпусе шкафа расположены рабочая камера, в которой имеются полки для размещения предметов для обработки, и нагревательные элементы, которые служат для равномерного нагрева воздуха в рабочей камере
Режимы стерилизации:
температура 1500С – 2 часа;
температура 1600С – 1700C 45 минут – 1час;
температура 1800C – 30 минут;
температура 2000C – 10-15 минут.
Необходимо помнить, что при температуре 1600С бумага и вата желтеют, при более высокой температуре – сгорают (обугливаются). Началом стерилизации является тот момент, когда температура в печи достигает нужной величины. После окончания стерилизации печь выключается, прибор остывает до 500С, после чего из него вынимают простерилизованные предметы.
Изделия в воздушном стерилизаторе можно стерилизовать без упаковки, но только в тех случаях, если они используются сразу же после стерилизации. В качестве упаковки может быть использована бумага мешочная, изготовленная по ГОСТ 2228-81, в ней изделия хранятся не менее 3-х суток.
Режим воздушной стерилизации представлен двумя значениями температуры – 1600С в течение 2,5 часов, либо 1800С – в течение 1 часа.
Стерилизация текучим паром. Этот вид стерилизации производится в аппарате Коха или в автоклаве при незавинченной крышке и открытом выпускном кране. Аппарат Коха представляет собой металлический полый цилиндр с двойным дном. Стерилизуемый материал загружают в камеру аппарата не плотно, для того, что бы обеспечить возможность наибольшего контакта его с паром. Начальный подогрев воды в приборе происходит в течение 10-15 минут.
Текучим паром стерилизуют материалы, которые разлагаются или портятся при температуре выше 1000С – питательные среды с углеводами, витаминами, растворы углеводов и т. п.
Стерилизацию текучим паром проводят дробным методом – при температуре не выше 1000С по 20-30 минут в течение 3-х дней. При этом вегетативные формы бактерий погибают, а споры сохраняют жизнеспособность и прорастают в течение суток при комнатной температуре. Последующее прогревание обеспечивает гибель этих вегетативных клеток, появляющихся из спор в промежутках между этапами стерилизации.
Тиндализация – метод дробной стерилизации, при котором прогревание стерилизуемого материала проводится при температуре 56-580С в течение часа 5-6 дней подряд.
Пастеризация – однократное нагревание материала до 50-650С (в течение 15-30 минут), 70-800С (в течение 5-10 минут). Используется для уничтожения бесспоровых форм микробов в пищевых продуктах (молоко, соки, вино, пиво).
Стерилизация паром под давлением. Стерилизация проводится в автоклаве под давлением обычно (посуда, физиологический раствор, дистиллированная вода, питательные среды, не содержащие белков и углеводов, различные приборы, изделия из резины) в течение 20-30 минут при температуре 120-1210С (1 атм.), хотя могут быть использованы и другие соотношения между временем и температурой в зависимости от стерилизуемого объекта.
Любые растворы, содержащие белки и углеводы, стерилизуют в автоклаве при 0,5 атм. (1150С) в течение 20-30 минут
Любой инфицированный микроорганизмами (заразный) материал стерилизуют при давлении в 1,5 атм. (1270С) – 1 час, или при давлении 2,0 атм. (1320С) – 30 минут.
Когда стерилизуемые растворы находятся в стеклянных сосудах, по окончании цикла стерилизации необходимо контролировать время охлаждения, а также медленно понижать давление, т.к. открывать автоклав можно только после того, как в нем установилось давление окружающей среды.
Стерилизация облучением. Излучение может быть неионизирующим (ультрафиолетовое, инфракрасное, ультразвуковое, радиочастотное) и ионизирующим – корпускулярным (электроны) и ли электромагнитным (рентгеновские лучи или гамма-лучи).
Эффективность облучения зависит от полученной дозы, а выбор дозы определяется микробным загрязнением, формой и составом материала, подлежащего стерилизации.
Ультрафиолетовое облучение (254 нм) обладает малой проникающей способностью, поэтому требует достаточно длительного воздействия и используется в основном для стерилизации воздуха, открытых поверхностей в помещениях.
Ионизирующее излучение, в первую очередь, гамма-облучение, успешно применяется для стерилизации в промышленных условиях медицинских изделий из термолабильных материалов, поскольку позволяют быстро облучать материалы еще на стадии производства (при любой температуре и герметичной упаковке). В настоящее время широко используется для получения стерильных одноразовых пластмассовых изделий (шприцы, системы для переливания крови, чашки Петри), и хирургических перевязочных и шовных материалов.
МЕХАНИЧЕСКИЕ МЕТОДЫ .Фильтры задерживают микроорганизмы благодаря пористой структуре матрикса, но для пропускания раствора через фильтр требуется вакуум или давление, поскольку сила поверхностного натяжения при таком малом размере пор не дает жидкостям фильтроваться.
Существуют 2 основных типа фильтров – глубинные и фильтрующие.
Глубинные фильтры состоят из волокнистых или гранулированных материалов (асбест, фарфор, глина), которые спрессованы, свиты или связаны в лабиринт проточных каналов, поэтому четкие параметры размера пор отсутствуют. Частицы задерживаются в них в результате адсорбции и механического захвата в матриксе фильтра, что обеспечивает достаточно большую емкость фильтров, но может приводить к задержке части раствора.
Фильтрующие фильтры имеют непрерывную структуру, и эффективность захвата ими частиц определяется в основном соответствию их размеру пор фильтра. Мембранные фильтры имеют низкую емкость, но эффективность не зависит от скорости протока и перепада давлений, а фильтрат почти или совсем не задерживается.
Мембранная фильтрация в настоящее время широко применяется для стерилизации масел, мазей и растворов, неустойчивых к нагреванию – растворы для внутривенных инъекций, диагностические препараты, растворы витаминов и антибиотиков, сред для культур тканей и т.д. и т.п..
ХИМИЧЕСКИЕ МЕТОДЫ. Химические методы стерилизации, связанные с применением химических веществ, обладающих явно выраженной антимикробной активностью, делятся на 2 группы: стерилизация газами и растворами (чаще известна как «дезинфекция»).
Химические методы стерилизации газами используются в лечебно-профилактических учреждениях для обеззараживания медицинских материалов и оборудования, которые нельзя стерилизовать другими способами (оптические приборы, кардиостимуляторы, аппараты искусственного кровообращения, эндоскопы, изделия из полимеров, стекла).
Бактерицидными свойствами обладают многие газы (формальдегид, окись пропилена, озон, надуксусную кислота и метилбромид), но шире всего используется окись этилена, поскольку она хорошо совместима с различными материалами (не вызывает коррозию металла, порчи обрабатываемых изделий из бумаги, резины и всех марок пластмасс). Время экспозиции при использовании газового метода стерилизации варьирует от 6 до 18 часов в зависимости от концентрации газовой смеси и объема специального аппарата (емкости) для этого вида стерилизации. Согласно «Методическим рекомендациям по дезинфекции, предстерилизационной очистке и стерилизации медицинских инструментов» №26-613 от 09.02.88г. для стерилизации газами в качестве газового стерилизационного аппарата возможно применение микроанаэростата, а кроме окиси этилена или смеси окиси этилена с бромистым метилом, – паров 40% формальдегида в этиловом спирте при температуре 800С в стерилизационной камере в течение 60 минут.
Контроль стерильности производят в специально оборудованных боксах, исключающих возможность вторичного контакта изделий с микрофлорой. Для контроля отбирают не менее 1% из числа одновременно простерилизированных изделий. Производят посев изделий в питательную среду для контроля. При отсутствии роста бактерий дают заключение о стерильности изделия.
Стерилизация растворами применяется при обработке больших поверхностей (пространств) или медицинских приборов, которые не могут быть обеззаражены другими методами.
Согласно требованиям отраслевого стандарта ОСТ 42-21-2-85 «Методические указания по дезинфекции, предстерилизационной очистке и стерилизации изделий медицинского назначения» большинство изделий медицинского назначения из металла, стекла, пластмасс, резины, проходят предстерилизационную обработку, состоящую из нескольких этапов:
– замачивание в моющем растворе при полном погружении изделия в дезинфицирующий раствор в течение 15-ти минут;
– мойка каждого изделия в разобранном виде в моющем растворе в ручном режиме в течение 1-ой минуты;
– ополаскивание под проточной водой хорошо промытых изделий в течение 3-10 минут;
– сушка горячим воздухом в сушильном шкафу.
Контроль качества предстерилизационной очистки изделий медицинского назначения на наличие крови проводят путем постановки амидопириновой пробы. Остаточные количества щелочных компонентов моющего средства определяют с помощью фенолфталеиновой пробы.
Согласно требованиям этого же ОСТа обязательным условием стерилизации растворами изделий медицинского назначения является полное погружение изделий в стерилизационный раствор в разобранном виде, с заполнением каналов и полостей, при температуре раствора не менее 18°С. Используют только эмалированные емкости (без повреждений) со стеклянными или пластмассовыми крышками. После стерилизации изделия быстро извлекают из раствора с помощью пинцетов или корнцангов, удаляют раствор из каналов и полостей, затем дважды последовательно промывают простерилизованные изделия стерильной водой. Простерилизованные изделия используют сразу по назначению или помещают в стерильную емкость, выложенную стерильной простыней, и хранят не более 3-х суток. В специальном журнале ведут обязательный учет всех циклов химической стерилизации с указанием даты, точного времени стерилизации (закладки, выемки раствора), название используемого препарата и его концентрации.
Препараты, используемые для стерилизации, классифицируются по группам: кислоты или щелочи, перекиси (6% раствор перекиси водорода), спирты (этиловый, изопропиловый), альдегиды (формальдегид, глутаровый альдегид), галогены (хлор, хлорамин, иодофоры – вескодин), четвертичные аммониевые основания, фенольные соединения (фенол, крезол).
Кроме того, в качестве удобных и экономичных дезинфицирующих растворов могут использоваться универсальные препараты, т.е. позволяющие проводить обеззараживание от всех форм микроорганизмов (бактерий, в том числе микобактерий туберкулеза, вирусов, включая ВИЧ, патогенных грибов) или комбинированные препараты («Дезэффект», «Аламинал», «Септодор», «Виркон»), совмещающие одновременно два процесса – дезинфекцию и предстерилизационную обработку.
Комплекс дезинфекционных мероприятий, ориентированных на удаление или уничтожение возбудителей инфекционных болезней в объектах или на абиотических объектах окружающей среды, т.е. при их передаче от источника к восприимчивым людям, делится на 2 вида: очаговая дезинфекция и профилактическая дезинфекция.
Очаговая дезинфекция осуществляется в эпидемических очагах и в свою очередь подразделяется на текущую, если источник возбудителя присутствует, и заключительную, если источник удален.
Текущая дезинфекция направлена на постоянное обеззараживание экскрементов, рвотных масс, мокроты, патологического отделяемого, перевязочного материала и др. объектов в окружении больного, которые обсеменены или могли быть обсеменены возбудителями в течение всего периода, пока больной или носитель служат источником возбудителя инфекции.
Заключительная дезинфекция направлена на уничтожение патогенных микроорганизмов, оставшихся в очаге в жизнеспособном состоянии на различных предметах, хотя источник удален, т.е. после госпитализации, выздоровления или смерти больного. При заключительной дезинфекции обработке подлежат помещения, экскременты, рвотные массы, белье, предметы быта и все другие объекты, которые могли быть контаминированы возбудителями данного заболевания. Этот вид дезинфекции, как правило, осуществляется специализированными службами органов госэпиднадзора.
Профилактическая дезинфекция проводится в том случае, если источник инфекции не обнаружен, но предполагается возможность его существования. Этот вид дезинфекции чаще всего используют в медицинских учреждениях (профилактика профессионального заражения медицинского персонала внутрибольничных инфекций), на предприятиях общественного питания, предприятиях, изготавливающих, перерабатывающих и реализующих пищевые продукты, а также в местах массовых скоплений людей, где может находиться источник возбудителя инфекционного заболевания среди здорового населения.
При кишечных инфекциях дезинфекционные мероприятия направлены на очистку и обеззараживание источников питьевого водоснабжения, сточных вод, отбросов, пищевых продуктов, материалов от больного, посуды, белья, пищеблоков, санузлов. В очаге проводят и текущую, и заключительную дезинфекцию.
При инфекциях дыхательных путей дезинфекцию проводят с целью снижения микробного загрязнения воздуха конкретных помещений, что может достигаться путем не только влажной уборки и обеззараживания объектов в окружении больного, но и проветривания или УФ-облучения воздуха в данном помещении.
В очагах трансмиссивных инфекций дезинфекционные мероприятия проводят только при чуме, туляремии, лихорадке Ку, и на объектах, где работают с кровью.
При инфекциях наружных покровов дезинфекции подлежат все вещи, бывшие в употреблении (белье, расчески, ножницы, губки) в банях, душевых, бассейнах, парикмахерских, причем рекомендуется по возможности использовать универсальные препараты, обладающие бактерицидным (в т.ч. спорицидным), вирулицидным, фунгицидным свойствами.
При профилактике внутрибольничных инфекций дезинфекции должны подвергаться все изделия медицинского назначения после каждого пациента, руки персонала, раневая поверхность, операционное поле и т.д. и т.п.
Биологическая стерилизация – основана на применении антибиотиков, используется ограниченно – в культурах тканей для культивирования вирусов.
Стерилизация Основные понятия и термины
Стерилизация – полное освобождение объектов внешней среды от вегетативных и покоящихся форм микроорганизмов путем использования физических или химических факторов.
Антисептика – комплекс лечебно-профилактических мероприятий, направленных на уничтожение микроорганизмов в ране, другом патологическом образовании или организме в целом.
Асептика — комплекс лечебно-профилактических мероприятий, направленных на предупреждение внедрения возбудителей инфекции в рану, ткани, органы, полости тела больного при любых медицинских (диагностических в том числе) манипуляциях.
Стерилизация проводится с целью: 1) предупреждения заноса микроорганизмов в организм человека при медицинских вмешательствах; 2) исключения микробной контаминации лекарственных и диагностических материалов, питательных сред и культур клеток, используемых при микробиологических и иммунологических исследованиях.
Этапы стерилизации
Стерилизация изделий медицинского назначения включает три этапа: 1) дезинфекцию; 2) предстерилизационную очистку и 3) собственно стерилизацию. Дезинфекции подлежат все изделия после применения их у пациентов.
Дезинфекцию изделий проводят с целью уничтожения патогенных и условно-патогенных микроорганизмов, в том числе возбудителей вирусных гепатитов и ВИЧ-инфекции, микобактерий туберкулеза и грибов, включая род кандида. После дезинфекции изделия промывают водой, высушивают и применяют по назначению или подвергают предстерилизационной очистке и стерилизации.
Предстерилизационную очистку проводят с целью удаления белковых, жировых и механических загрязнений, а также остатков лекарственных препаратов.
Стерилизацию изделий проводят с целью уничтожения микроорганизмов всех видов, в том числе споровых форм. Стерилизации подлежат все изделия медицинского назначения, соприкасающиеся с раневой поверхностью, слизистыми оболочками при риске вызвать их повреждения, а также контактирующие с кровью или инъекционными препаратами.
Дезинфекция изделий медицинского назначения.
Дезинфекцию изделий медицинского назначения осуществляют физическим и химическим методами. Выбор метода зависит от особенностей изделия, материалов, используемых при производстве изделий, и их назначения.
Физический метод дезинфекциивключает кипячение, воздействие водяного насыщенного пара или сухого горячего воздуха.
Кипячение инструментов проводят в дистиллированной воде в течение 30 мин с момента закипания или в воде с добавлением 2% раствора питьевой соды (натрия двууглекислого) в течение 15 мин с момента закипания. Данному виду дезинфекции подвергают изделия из стекла, металлов, термостойких полимерных материалов и резин. Перед кипячением изделия очищают от органических загрязнений, промывая водопроводной водой или раствором дезинфицирующих средств, не обладающих фиксирующим действием, в специальные емкости (с соблюдением мер безопасности при работе с биологическим материалом). Промывные воды далее дезинфицируют.
Паровым методом с использованием водяного насыщенного пара под избыточным давлением дезинфицируют изделия из стекла, металлов, резин, латекса, термостойких полимерных материалов. Их складывают в стерилизационные коробки (биксы) и помещают в паровой стерилизатор (автоклав). Автоклавирование происходит при 110С в течение 20 мин. Предварительная очистка изделий от органических загрязнений не требуется.
Воздушным методом дезинфицируют изделия из стекла, металлов, силиконовой резины в открытом виде на полках воздушного стерилизатора (сухожаровой печи) при температуре 120С в течение 45 мин. При этом требуется обязательная предварительная очистка изделий от органических загрязнений.
Физический метод дезинфекции изделий медицинского назначения прост, экологически чист и безопасен для персонала.
Химический метод дезинфекции предполагает использование растворов химических веществ-дезинфектантов, куда погружают медицинские изделия сразу после их применения у пациентов. Предварительно изделия очищают от органических загрязнений во избежание снижения эффективности рабочих растворов. Разъемные изделия дезинфицируют в разобранном виде, каналы и полости изделий должны быть заполнены дезинфицирующим раствором. Изделия, не соприкасающиеся непосредственно с пациентом, могут быть обеззаражены путем двукратного протирания салфеткой, смоченной раствором дезинфицирующего средства.
Для химического метода дезинфекции применяют вещества, обладающие вирулицидным действием в отношении возбудителей вирусных гепатитов и ВИЧ-инфекции (Аламинол, Жавель, Лизоформин-3000, ПВК, Комбидезинфектант инструментарияи др.), а в противотуберкулезных организациях – вещества микобактерицидного действия (Сайдекс, Септодор, Хлорамин Б, Жавелион). Дезинфекция проводится по режимам, рекомендованным для этих инфекций. Дезинфицирующие средства, не обладающие такими свойствами, не должны использоваться для обеззараживания изделий медицинского назначения.
Хлорсодержащие вещества, а также большинство средств на основе перекиси водорода предназначают для изделий из коррозионностойких металлов, резин, пластмасс, стекла. Применение спирта этилового рекомендуют только для дезинфекции изделий из металлов после предварительной очистки их от органических соединений. Альдегидсодержащие средства рекомендованы для изделий из стекла, металлов, полимерных материалов, в том числе термолабильных. Для дезинфекции изделий медицинского назначения допускается применение перекиси водорода.
В целях предотвращения выработки устойчивости микроорганизмов к дезинфицирующим средствам рекомендуется еженедельная смена химических дезинфектантов, входящих в иную группу препаратов по активно действующему веществу.
По окончании дезинфекции медицинские изделия промывают проточной водой, проводят механическую очистку их ершами, щетками, салфетками, после чего используют по назначению или переходят к следующему этапу стерилизации – предстерилизационной очистке.
стерилизация
Уничтожение микробов в окружающей среде
Для уничтожения микробов (бактерий, вирусов, грибов и простейших) на различных предметах и в материалах, используемых в медицине, в пищевой промышленности и в быту, применяют два способа: стерилизацию и дезинфекцию.
Стерилизация
Стерилизация (от лат. sterilis — бесплодный) предполагает полную инактивацию микробов в объектах, подвергающихся обработке.
Существует три основных метода стерилизации:
тепловой,
лучевой,
химической.
Тепловая стерилизация основана на чувствительности .микробов к высокой температуре. При 60 «С и наличии воды происходит денатурация белка, деградация нуклеиновых кислот, липидов, вследствие чего вегетативные формы микробов погибают. Споры, содержащие очень большое количество воды в связанном состоянии и обладающие плотными оболочками, инактивируются при 160—170 °С.
Для тепловой стерилизации применяют, в основном, сухой жар и пар под давлением.
Стерилизацию сухим жаром осуществляют в воздушных стерилизаторах (прежнее название — «сухожаровые шкафы или печи Пастера»). Воздушный стерилизатор представляет собой металлический плотно закрывающийся шкаф, нагревающийся с помощью электричества и снабженный термометром. Обеззараживание материала в нем производят, как правило, при 160 °С в течение 120 мин. Однако возможны и другие режимы: 200 °С — 30 мин, 180 «С — 40 мин.
Стерилизуют сухим жаром лабораторную посуду и другие изделия из стекла, инструменты, силиконовую резину, т. е. объекты, которые не теряют своих качеств при высокой температуре.
Большая часть стерилизуемых предметов не выдерживает подобной обработки, и поэтому их обеззараживают в паровых стерилизаторах.
Обработка паром под давлением в паровых стерилизаторах (старое название — «автоклавы») является наиболее универсальным методом стерилизации.
Паровой стерилизатор (существует множество его модификаций) — металлический цилиндр с прочными стенками, герметически закрывающийся, состоящий из водопаровой и стерилизующей камер. Аппарат снабжен манометром, термометром и другими контрольно-измерительными приборами. В автоклаве создается повышенное давление, что приводит к увеличению температуры кипения. Поскольку кроме высокой температуры на микробы оказывает воздействие и пар, споры погибают уже при 120 °С. Наиболее распространенный режим работы парового стерилизатора: 2 атм — 121 °С — 15—20 мин. Время стерилизации уменьшается при повышении атмосферного давления, а следовательно, и температуры кипения (136 °С — 5 мин). Микробы погибают за несколько секунд, но обработку материала производят в течение большего времени, так как, во-первых, высокая температура должна быть и внутри стерилизуемого материала и, во-вторых, существует так называемое поле безопасности (рассчитанное на небольшую неисправность автоклава).
Стерилизуют в автоклаве большую часть предметов: перевязочный материал, белье, коррозионно-устойчивые металлические инструменты, питательные среды, растворы, инфекционный материал и т. д.
Эффективность стерилизации в паровом стерилизаторе зависит от правильного выбора упаковки, соблюдения правил загрузки для свободного прохождения пара (например, перевязочный материал укладывают в камеру параллельно движению пара), плотности загрузки камеры и других факторов.
Одной из разновидностей тепловой стерилизации является дробная стерилизация, которую применяют для обработки материалов, не выдерживающих температуру выше 100 «С, например, для стерилизации питательных сред с углеводами, желатина. Их нагревают в водяной бане при 80 «С в течение 30—60 мин, в результате чего вегетативные формы погибают. Процедуру повторяют три дня подряд, в промежутках между манипуляциями питательные среды выдерживают в термостате, что способствует прорастанию спор. Иногда эту процедуру производят в автоклаве при давлении 0,5 атм.
В настоящее время применяют еще один метод тепловой стерилизации, предназначенный специально для молока — ультравысокотемпературный (УВТ): молоко обрабатывают в течение нескольких секунд при 130—150 °С.
Тепловая стерилизация — наиболее надежный, экологически безопасный, дешевый и хорошо контролируемый метод. Однако его невозможно применять тогда, когда предметы повреждаются от высокой температуры. В этих случаях прибегают к другим методам.
Химическая стерилизация предполагает использование токсичных газов: оксида этилена, смеси ОБ (смеси оксида этилена и бромистого метила в весовом соотношении 1:2,5) и формальдегида. Эти вещества являются алкилирующими агентами, их способность в присутствии воды инактивировать активные группы в ферментах, других белках, ДНК и РНК приводит к гибели микроорганизмов.
Стерилизация газами осуществляется в присутствии пара при температуре от 18 до 80 °С в специальных камерах. В больницах используют формальдегид, в промышленных условиях — оксид этилена и смесь ОБ.
Перед химической стерилизацией все изделия, подлежащие обработке, должны быть высушены.
Этот вид стерилизации небезопасен для персонала, для окружающей среды и для пациентов, пользующихся простерилизованными предметами (большинство стерилизующих агентов остается на предметах).
Однако существуют объекты, которые могут быть повреждены нагреванием, например, оптические приборы, радио- и электронная аппаратура, предметы из нетермостойких полимеров, питательные среды с белком и т. п., для которых пригодна только химическая стерилизация. Например, космические корабли и спутники, укомплектованные точной аппаратурой, для их деконтаминации обезвреживают газовой смесью (оксид этилена и бромистого метила).
В последнее время в связи с широким распространением в медицинской практике изделий из термолабильных материалов, снабжен-
ных оптическими устройствами, например эндоскопов, стали применять обезвреживание с помощью химических растворов. После очистки и дезинфекции прибор помещают на определенное время (от 45 до 60 мин) в стерилизующий раствор, затем прибор должен быть отмыт стерильной водой. Для стерилизации и отмывки используют стерильные емкости с крышками. Простерилизованное и‘ отмытое от стерилизующего раствора изделие высушивают стерильными салфетками и помещают в стерильную емкость. Все манипуляции проводят в асептических условиях и в стерильных перчатках. Хранят эти изделия не более 3 суток.
Лучевая стерилизация осуществляется либо с помощью гамма-излучения, либо с помощью ускоренных электронов.
Источником гамма-излучения, получаемого в специальных гамма-установках, являются радиоактивные изотопы, например 60Со, l37Cs. Для получения электронного излучения применяют ускорители электронов (с высоким уровнем энергии — 5—10 MeV).
Гибель микробов под действием гамма-лучей и ускоренных электронов происходит прежде всего в результате повреждения нуклеиновых кислот. Причем микробы более устойчивы к облучению, чем многоклеточные организмы.
Лучевая стерилизация является альтернативой газовой стерилизации в промышленных условиях, и применяют ее также в тех случаях, когда стерилизуемые предметы не выдерживают высокой температуры. Лучевая стерилизация позволяет обрабатывать сразу большое количество предметов (например, одноразовых шприцев, систем для переливания крови). Благодаря возможности широкомасштабной стерилизации, применение этого метода вполне оправданно, несмотря на его экологическую опасность и неэкономичность.
Еще
одним способом стерилизации является фильтрование. Фильтрование с помощью различных
фильтров (керамических, асбестовых,
стеклянных),
а в особенности мембранных ультрафильтров
из коллоидных растворов нитроцел люлозы
или других веществ позволяет освободить
жидкости
(сыворотку крови, лекарства) от бактерий,
грибов, простейших и даже вирусов. Дли
ускорения
процесса фильтрации обычно создают
повышенное давление в емкости с
фильтруемой жидкостью
или пониженное давление в емкости с
фильтратом.
люлозы
или других веществ позволяет освободить
жидкости
(сыворотку крови, лекарства) от бактерий,
грибов, простейших и даже вирусов. Дли
ускорения
процесса фильтрации обычно создают
повышенное давление в емкости с
фильтруемой жидкостью
или пониженное давление в емкости с
фильтратом.
В настоящее время все более широкое применение находят современные методы стерилизации, созданные на основе новых технологий, с использованием плазмы, озона.
Микробиологический контроль объектов, подвергшихся стерилизации, в повседневной практике не производится. Его заменяет косвенный контроль — контроль работы стерилизаторов, который осуществляется несколькими способами. Во-первых, персонал должен строго соблюдать и документировать установленный режим стерилизации, который обеспечивает гибель микробов. Во-вторых, косвенно о поддержании определенной температуры можно судить по изменению окраски химических индикаторов (либо индикаторных бумажек, либо порошков, жидкостей — бензойной кислоты, мочевины, запаянных в ампулы), которые помещают на поверхности и в глубине стерилизуемого объекта. В-третьих, должен регулярно проводиться технический контроль аппаратуры соответствующей службой. В-четвертых, три раза в году осуществляют биологический контроль, помещая внутрь стерилизуемых предметов биотесты, приготовленные из термоустойчивых бацилл Вас. stearothermophilus ВКМ-718.
Для проведения микробиологического контроля производят посев кусочков материала, смывов с предметов, подвергшихся стерилизации, на среды, позволяющие обнаружить аэробные и анаэробные бактерии, грибы (сахарный бульон, тиогликолевую среду, среду Сабуро). Отсутствие роста после 14 дней инкубации в термостате свидетельствует о стерильности предмета. Более тщательный контроль стерильности осуществляют в промышленных условиях, отбирая случайным методом некоторое количество образцов.
После процедуры стерилизации должна сохраняться стерильность, которую поддерживают с помощью упаковки: полимерной пленки, бумаги, фольги, биксов, металлических пеналов и др.
Существует общий стандарт для всех видов стерилизации, принятый Европейской Фармакопеей в 1983 г.: после завершения стерилизации на лечебном материале может оставаться некоторое количество жизнеспособных микроорганизмов — 1 из 106.
Дезинфекция
Дезинфекция (от франц. приставки des, обозначающей удаление, уничтожение инфекционного начала) — процедура, предусматривающая обработку загрязненного микробами предмета с целью их уничтожения до такой степени, чтобы они не смоли вызвать инфекцию при использовании данного предмета. Как правило, при дезинфекции погибает большая часть микробов (в том числе все патогенные), однако споры и некоторые резистентные вирусы могут остаться в жизнеспособном состоянии.
Стерилизация — лучший способ обеззараживания. Однако, если отсутствует возможность подвергнуть предмет стерилизации, проводится дезинфекция. Например, нельзя простерилизовать бокс, в котором ведутся работы с заразным материалом, операционный стол, руки хирурга или оптиковолоконные микроскопы.
После дезинфекции, в отличие от стерилизации, нет необходимости защищать продезинфицированный материал от попадания микробов извне. До стерилизации предмет необходимо тщательно отчистить от грязи, крови, химических веществ (в том числе и лекарств) и вымыть, чтобы сократить количество микробов на нем. Дезинфекция нередко выполняется перед процедурой чистки для обеспечения безопасности медперсонала.
Различают три основных метода дезинфекции:
тепловой,
химический,
УФ-облучение.
Выбор того или иного метода также зависит от дезинфицируемого материала.
Тепловая
дезинфекция. Очень
эффективным является
действие горячей воды и насыщенного
пара. Рекомендуется следующее время
воздействия:
при 80 «С — 10 мин, при 85 «С — 3
мин, при 90 °С — 1 мин. При этом режиме  погибают
все вегетативные формы бактерий и
большинство вирусов. Температура 100 °С
в течение
5 мин убивает все вегетативные формы
бактерий и все вирусы.
погибают
все вегетативные формы бактерий и
большинство вирусов. Температура 100 °С
в течение
5 мин убивает все вегетативные формы
бактерий и все вирусы.
При добавлении в воду 2 % натрия гидрокарбоната (NaHCO3) погибают и споры. Кроме того, добавление соды имеет дополнительные преимущества: сода растворяет белки и жиры, которые могут находиться на поверхности предмета, предупреждает коррозию инструментов и оседание на них кальция. Подобным образом можно обрабатывать инструменты, иглы, шприцы и т. д.
Более удобным является применение автоматических моечных машин, в которых предметы сначала промываются в холодной воде, затем — в теплой с детергентом, далее — в чистой и, наконец, дезинфицируются в дистиллированной воде при 90 °С.
Обычные процессы стирки белья, приготовление пищи и кипячение питьевой воды являются примером использования дезинфекции в быту.
Для дезинфекции применяют также сухое тепло, например, прокаливание.
Тепловая дезинфекция — это единственный метод, который не вызывает загрязнения окружающей среды; кроме того, он является наиболее эффективным и дешевым.
Разновидностью тепловой дезинфекции является пастеризация — метод, созданный Л. Пастером и применяемый для обработки в основном молока, а также соков, вина и пива. При используемом обычно режиме — 60—70 °С в течение 20—30 мин — погибает большинство вегетативных форм бактерий (особенно важно уничтожение бруцелл и Mycobacterium bovis, которые могут находиться в молоке), но сохраняется часть энтерококков, молочнокислых бактерий и споры. Поэтому пастеризованное молоко помещают на холод для предотвращения и прорастания спор и размножения бактерий.
Химическая дезинфекция проводится с помощью различных дезинфицирующих веществ. Дезинфектанты действуют, например, растворяя липиды клеточных оболочек (детергенты) или разрушая белки и нуклеиновые кислоты (денатураты, оксиданты). Активность каждого из дезинфектантов неодинакова для различных микроорганизмов и зависит от температуры, рН и прочих условий.
В качестве контрольных микроорганизмов для изучения действия дезинфектантов используют S. typhi и S. аигеш.
Обеззараживанию с помощью данного метода подлежат, например, поверхность операционного стола, стены процедурного кабинета, кожа, некоторые инструменты — все то, что невозможно обработать теплом. Еще одним примером химической дезинфекции является хлорирование воды.
Использование большинства дезинфицирующих веществ опасно для медперсонала, они загрязняют окружающую среду, многие из них дорогостоящи.
Ультрафиолетовое облучение (лучи с длиной волны 200—400 нм) производится с помощью специальных бактерицидных ламп (настенных, потолочных, передвижных и др.) для обеззараживания воздуха, различных поверхностей в операционных, перевязочных, микробиологических лабораториях, предприятиях пищевой промышленности и т. д. Действие ультрафиолетовых лучей приводит к разрушению ДНК микробов в результате образования тиминовых димеров.
Очень незначительна роль механической дезинфекции: проветривания, вентиляции, обработки пылесосом и т. п.
Различают профилактическую дезинфекцию в эпидемическом очаге, которая осуществляется с целью предупреждения распространения различных болезней. При возникновении эпидемического очага проводят текущую (во время вспышки) и заключительную (после ее окончания) дезинфекцию; подобные процедуры проводятся как в медицинских учреждениях, так и за их пределами.
Асептика и антисептика
Для профилактики внутрибольничных, и в особенности хирургических, инфекций применяют асептику и антисептику.
Асептика, основоположником которой является Д. Листер (1867), — это комплекс мер, направленных на предупреждение попадания возбудителя инфекции в рану, органы больного при операциях, лечебных и диагностических процедурах. Методы асептики применяют для
борьбы с экзогенной инфекцией, источниками которой являются больные и бактерионосители.
Асептика включает:
стерилизацию и сохранение стерильности инструментов, перевязочного материала, операционного белья, перчаток и всего, что приходит в соприкосновение с раной; дезинфекцию рук хирурга, операционного поля, аппаратуры, операционной и других помещений, применение специальной одежды, масок.
К мерам асептики относится также планировка операционных (этаж, боксирование, вентиляция, кондиционирование воздуха и т. п.).
Методы асептики находят также применение в микробиологических производствах, на предприятиях пищевой промышленности.
Антисептика — совокупность мер, направленных на уничтожение микробов в ране, патологическом очаге или организме в целом, на предупреждение или ликвидацию воспалительного процесса.
10
Презентация на тему: Виды стерилизации
• Горячая стерилизация
1.Сухожаровой шкаф
2.Автоклавирование
3.Обжигание
• Холодная стерилизация
1.Стерилизация гамма- лучами
2.Стерилизация в парах антисептика
3.Замачивание в антисептике
Стерилизация в сухожаровых шкафах
•Принцип- стерилизация горячим сухим воздухом
•Стерилизуются металлические инструменты
•Укладка на решетки в 1 слой
•Т =180 градусов, время = 1 час
•Хранение на стерильном столе — 6 часов
Стерилизация в автоклаве
•Принципстерилизация паром под давлением
•Давление необходимо для повышения температуры выше 100 градусов (закон Шарля)
•Стерилизуются белье, тампоны, салфетки, бинты, перчатки, катетеры
•Они укладываются в бикс Шиммельбуша по секторам
•Время стерилизации: 1.5 атм- 20 мин, 1.1 атм – 45 мин
•Хранение в биксе при закрытых решетках 48 часов
Стерилизация в парах антисептика
•Используется газовый стерилизатор
•Антисептик – формалин или окись этилена
•Экспозиция: 16 часов при 18 градусах или 6 часов при 55 градусах
Способы контроля за стерильностью
•Прямой метод – посев на флору (1 раз в 10 дней)
•Непрямой метод – в бикс или сухожаровой шкаф кладется ТВИ (термовременной индикатор), при Т выше 110 градусов он меняет окраску на коричневую, цвет индикатора сравнивается с эталоном
Способы обработки рук хирурга
•Фюрбрингера- предварительное мытье+сушка+сулема 1 мин+спирт 3 мин
•Альфельда- мытье+сушка+спирт 5 мин
•Спасокукоцкого- Кочергина 0.5% нашатырный спирт в 2 тазах 3мин+3 мин, затем – 96% спирт 5 мин
•Способ Бруна: спирт 10 мин
•Первомур (перекись водорода+муравьиная кислота) — 1 мин
•Спиртовый раствор хлоргексидина 2-3 мин
•Хибискраб 2-3 мин
•Пливасепт 2-3 мин
•Новосепт 2-3 мин
•Церигель – до высыхания пленки (около 1 мин)
Профилактика имплантационной инфекции
Стерилизация шовного материала:
•Атравматические нити — гамма лучи
•Капрон, лавсан- автоклав
•Шелк- способ Кохера (мыльная вода, проточн вода, высушивание, эфир 24ч, 70% спирт- 24ч, кипячение в сулеме — 20 мин, хранение в 96% спирте.
•Кетгут:
1.- способ Клаудиуса: эфир 24ч, водный р-р Люголя — 10 сут, водный р-р Люголя — еще 10 сут, хранят в 96% спирте
2.- способ Губарева: эфир 24ч, спиртовый р-р Люголя — 10 сут,
3.- способ Ситковского: эфир 24ч, йодид калия 1-3 мин, пары йода 3-5 суток.
Требования к шовному материалу
•Нить является продолжением иглы
•Отсутствие пилящих ткани свойств
•Прочность
•Хорошие манипуляционные свойства
•Способность к биодеструкции в заданный период времени
•Отсутствие реакции тканей на нить
•Гидрофобность
•Доступность стерилизационной обработке
Профилактика эндогенной инфекции
•Профилактика гематогенного и лимфогенного путей – дооперационная санация всех очагов воспаления
•Профилактика контактного пути:
1.Подготовка кожи
2.Подготовка полых органов
3.Антибиотикопрофилактика
4.Обработка операционного поля
5.Деление операции на этапы
Подготовка полых органов
•Промывание желудка
•Очищение кишечника (клизмы, макроголь)
•Санация полости рта
•Санация трахеи и бронхов
•Санация влагалища
