Холодная стерилизация | Медицинский портал
Холодная стерилизация.
Методы холодной стерилизации применяют в том случае, если объект не выдерживает нагревания. Фильтрованием стерилизуют синтетические среды и растворы, в состав которых входят термолабильные или летучие компоненты. Фильтры не только задерживают клетки микроорганизмов из-за малого размера пор (0,2—0,7 мкм), но и адсорбируют их. Фильтры могут быть изготовлены из разных мелкопористых материалов (асбеста, каолина, целлюлозы, фарфора). Сами фильтры стерилизуют автоклавированием при 1,0 ати 15—30 мин.
Стерилизация с помощью газов эффективна при обработке оптического и радиоэлектронного оборудования и изделий из термолабильных пластмасс. Стерилизующие вещества должны убивать эндосперм микроорганизмов. Перед обработкой объекты упаковывают в оберточную бумагу или в пленки, пропускающие газ и влагу и не портящиеся в газовой среде, и помещают в герметически закрывающуюся камеру. Из камеры отсасывают воздух и заполняют ее газом. В зависимости от свойств используемого газа поддерживается определенная температура и длительность стерилизации. После обработки газ из камеры удаляют и выдерживают объект в стерильной воздушной среде не менее 24 ч. Наиболее часто применяют такие газы, как оксиды этилена и пропилена, метилбромид, озон, пары формальдегида и глутарового альдегида.
Стерилизацию облучением используют для обработки помещений, оборудования, объектов медицинской и пищевой промышленности. В качестве действующих агентов применяют различные виды излучений (инфракрасное, ультрафиолетовое, рентгеновское, а-, р- и у-излучения) с дозами не меньше 2—3 мрад. В микробиологической лаборатории воздух и рабочие поверхности стерилизуют длительным облучением ультрафиолетом (X = 260 нм, 12—24 ч). Стерилизацию облучением применяют также при изготовлении одноразовой пластиковой посуды, шприцов и инструментов для микробиологических исследований.
Похожие медицинские статьи:
Методы стерилизации
Почти все факторы физического воздействия на микроорганизмы могут быть использованы с целью стерилизации. Под стерилизацией понимают обеспложивание, освобождение материалов, растворов, питательных сред от вегетативных и покоящихся форм микроорганизмов. Стерильность — понятие абсолютное, оно означает полное отсутствие микроорганизмов, как на поверхности, так и внутри стерильного объекта.В практике широко используют несколько способов стерилизации: термическая (под действие высоких температур) и холодная (с помощью ультразвука, излучения, фильтрации).
Гибель клеток бактерий, грибов, дрожжей и вирусных частиц при стерилизации высокой температурой происходит либо в результате сгорания клеток, либо в результате коагуляции белковых структур микроорганизмов. Различают следующие способы тепловой стерилизации:
Прокаливание. Это самый старый и надежный способ стерилизации. В пламени горелки прокаливают бактериологические петли, препаровальные иглы, кончики пинцетов и ножниц, предметные стекла. При этом бактерии, грибы и их споры сгорают.
Кипячение. Для стерилизации металлических инструментов, стеклянных изделий, резиновых трубок, пробок используют кипящую воду. При 1000С (температура кипящей воды) вегетативные формы микроорганизмов и большинство вирусов погибают быстро, в течение нескольких минут. Споры (бациллы сибирской язвы, ботулизма) выдерживают кипячение в течение нескольких часов, вирусы гепатита В – около часа. Стерилизацию осуществляют в специальных металлических сосудах – стерилизаторах, которые могут быть снабжены электронагревом. Существует большое количество типов стерилизаторов, отличающихся по объему и устройству.
Стерилизация сухим жаром. Для стеклянной посуды чаще всего используют стерилизацию сухим жаром. Ее проводят в специальных суховоздушных (сухожарочных) шкафах, имеющих датчики – регуляторы температуры. Режимы стерилизации включают температуру и время. Наиболее часто используют следующие режимы стерилизации сухим жаром:Температура, 0С | Время, мин |
140 | 180 |
150 | 150 |
160 | 120 |
170 | 60 |
При таких режимах погибают как вегетативные формы, так и споры микроорганизмов.
Автоклавирование – стерилизация насыщенным паром под
давлением. Проводится при температуре
выше точки кипения воды. Это наиболее
надежный и распространенный способ
стерилизации. Особая эффективность
этого способа достигается при совместном
действии пара и высокой температуры.
Стерилизацию паром под давлением
осуществляют в специальных герметически
закрывающихся аппаратах с толстыми
стенками – автоклавах. Автоклав состоит
из стерилизационной камеры, снабженной
краном для выхода воздуха, манометром
для измерения давления пара,
предохранительным клапаном для выхода
пара при повышении давления выше
необходимого, термометра для измерения
температуры внутри камеры. Имеется
паровой котел с нагревателем воды. При
кипячении воды пар поступает в камеру
автоклава. Автоклав герметически
закрывают крышкой или дверью с плотной
резиновой прокладкой. Автоклавирование
проводит специально подготовленный
специалист, так как работа по обслуживанию
аппарата, работающего под давлением
требует подготовки и строгого соблюдения
правил техники безопасности. Режим
автоклавирования выражают в единицах
избыточного давления и продолжительности
времени. Избыточное давление в 1 атм
устанавливается при достижении
температуры в камере 121 0,
1,5 атм – 1250,
2,0 атм – 1340.
При таких режимах автоклавирования
вегетативные формы микроорганизмов
погибают в течение нескольких минут, а
споры в течение 20-30 мин. Режим стерилизации
выбирают в зависимости от свойств
стерилизуемого материала. Так, питательные
среды стерилизуют 20-30 мин при 1 атм,
перевязочный материал и резиновые
изделия от 1 до 2 часов при 1,0-1,5 атм. Для
контроля режима стерилизации используют
вещества с определенной температурой
плавления. Их смешивают с метиленовой
синью, помещают в ампулы или небольшие
флаконы и раскладывают в автоклаве
перед началом автоклавирования. К таким
контролирующим веществам относятся
бензаурин, температура плавления 115
Стерилизации текучим паром подвергаются те растворы и питательные среды, которые разрушаются при стерилизации под давлением. Такую стерилизацию проводят также в автоклавах при избыточном нулевом давлении и температуре 1000. Применяют «дробную стерилизацию» — трех- или четырехкратную обработку с интервалом в 1 сут, во время которого не успевшие погибнуть споры бактерий прорастают в вегетативные формы и погибают от действия пара и температур.
Пастеризация предусматривает уничтожение в материале только вегетативных форм микроорганизмов и применяется в пищевой промышленности. При этом используют кратковременное нагревание до 90-92 0 в течение 2-5 сек или более длительное — в течение 5-10 мин нагревание до 70-750. Обработанные таким образом материалы считаются пастеризованными, но не стерильными, так как содержат споры.
Холодная
стерилизация осуществляется в отношении материалов,
сред и растворов, которые изменяют
свойства при тепловой стерилизации.
Стерилизация фильтрованием показана
для синтетических сред определенного
состава, содержащих термолабильные
аминокислоты, витамины, белки, для
антибиотиков, ароматических углеводородов.
Фильтрование проводится через
мелкопористые материалы, которые
адсорбируют клетки микроорганизмов:
каолин, асбест, фарфор и др. Диски,
изготовленные из асбеста с целлюлозой
называют фильтрами Зейтца. Их помещают
в специальный фильтродержатель и
стерилизуют в автоклаве, а затем,
смонтировав держатель с колбой или
бутылью, под давлением пропускают
стерилизуемый раствор. Широкое применение
нашли мембранные фильтры. Их изготавливают
из специально обработанной нитроцеллюлозы.
Фильтры имеют поры размером от 0,22 до
100 мм. В фильтродержатели монтируют
фильтры с разной величиной пор, от
больших к меньшим и при фильтрации
растворов постепенно «отсеивают»
микроорганизмы различных размеров.
Наиболее широко известны фильтрующие
пластины фирм «Миллипор», «Синпор»,
«Владипор». После стерилизующей
фильтрации среды и растворы обязательно
проверяют на стерильность, помещая
микропробы простерилизованных растворов
в термостат при температуре 37
Методы и режимы стерилизации :: BusinessMan.ru
В общем представлении стерилизацией называется процесс, при котором уничтожаются все виды микробов, а также их возможные споры. Существуют разные направления использования такой формы борьбы с нежелательными бактериями, но чаще всего ее применяют в медицине. Как правило, для глубокой очистки инструментов и материалов, которые предназначены для непосредственного контакта с поврежденной поверхностью – раной, кровью, слизистыми оболочками и т. д. В зависимости от характера решаемой задачи и условий применения очистки, могут использоваться разные техники и режимы стерилизации, отличающиеся эффективностью, широтой охвата, побочными эффектами и другими параметрами.

Режимы химического метода стерилизации
В основном для данного вида обработки используют дезинфицирующие препараты и другие средства, позволяющие с разной степенью реализовать очистку целевого материала от микробов. В частности, может использоваться окись пропилена, бромистый метил, оксид этилена и прочие смеси на основе этих компонентов. Что касается режимов химической стерилизации, то они определяются температурным показателем и активной средой, в которой происходит процесс. Высокий термический режим в данном случае не требуется – для успешной реакций обработки достаточно 50-70 °С. Среды могут быть разными. Популярностью пользуются растворы перекиси водорода, в которые погружаются металлические, стеклянные, полимерные и полиэтиленовые изделия. Режимы обработки также будут различаться по времени – от 3 ч до 3 суток.
Паровой метод стерилизации и его рабочие режимы

Широко используемый способ, у которого немало преимуществ. Например, воздействие горячими парами экологически безопасно для окружающих, что обуславливает частое применение этого метода в стационарах. В то же время есть у него и слабые стороны, в числе которых невысокая эффективность и требовательность к поддержанию стабильных условий температурно-влажностного режима. Собственно, водяной насыщенный пар, работающий под давлением, выступает активным дезинфицирующим компонентом, параметры которого и определяют формат обработки. Стандартным считается режим паровой стерилизации, осуществляемый при поддерживаемом давлении в диапазоне от 0,05 до 0,21 МПа. Температурный коридор, в свою очередь, можно представить спектром от 110 до 135 °С. Временной цикл варьируется от 5 до 180 мин. Это говорит о том, что паровой обработке может поддаваться и материал с высокой чувствительностью к термическому воздействию.
Режимы при выполнении воздушной стерилизации
Методика сухой высокотемпературной дезинфекции медицинского инструмента при температурных показателях от 30 до 200 °С. Режимы отличаются по времени проведения полного цикла и уровню термического воздействия прямо пропорционально. То есть по мере наращивания температуры сокращается временной интервал – и наоборот. К примеру, наиболее эффективный режим воздушной стерилизации выполняется при 200 °С, но завершается уже через 30 мин. С другой стороны, при минимальных показателях температуры воздуха качественная операция может решить задачу дезинфекции только при длительном воздействии в течение 180 мин. Несмотря на схожесть данного метода с паровой обработкой, у него есть принципиальные отличия. В первую очередь, это ограничения по использованию пластмассовых изделий. Также перед началом воздушной очистки требуется предварительная подготовка целевого объекта в сушильной камере.

Режимы стерилизации в сухожаровом шкафу
Можно сказать, это улучшенная технология стандартной обработки сухими воздушными потоками. Разница заключается в повышении температурного режима до 250 °С. Причем временной интервал сокращается в максимальной точке до 120 мин. Так, диапазон термического воздействия от 150 до 200 °С при длительности 60-90 мин охватывает оптимальные режимы стерилизации изделий медицинского назначения, которые требуется не только дезинфицировать, но и охлаждать сразу после чистки. К слову, сухожаровые камеры работают с возможностью тонких настроек по разным параметрам и в режимах принудительного охлаждения. Взаимодействие с оборудованием происходит через подключенный ПК и специальную программу с перечнем базовых и дополнительных настроек обработки.
Стерилизация в автоклаве
Как и воздушное воздействие, процесс подачи горячего пара может быть оптимизирован благодаря специальному оборудованию. Нельзя сказать, что автоклавы предназначены исключительно для паровой обработки, но с точки зрения именно дезинфекции такие камеры интересны как раз этой стороной эксплуатации. Практикуется использование двух режимов стерилизации в автоклаве: при давлении 0,2 МПа и температуре 130 °C, и при давлении 0,1 МПа и термическом воздействии 120 °C. При этом оператор может использовать встроенные режимы для работы с тем или иным видом изделий. Это касается, в частности, возможностей медицинского автоклава, который содержит отдельные программы для неупакованных твердых инструментов, пористых материалов, упакованных полых предметов и т. д.

Гласперленовая стерилизация
Довольно сложный, но эффективный и производительный метод обработки различных изделий посредством горячих стеклянных шариков. Особенностью данного способа является высокий температурный режим среды, который может достигать 330 °С. Для обработки целевой объект погружается в наполнитель с гранулами диаметром 15 мм и более. Что касается времени, то режимы стерилизации такого рода предполагают удержание предмета в активной среде от 20 до 180 сек. Отсутствие прямого химико-влажностного контакта с объектами обработки расширяет возможности применения гласперленового метода, но сам механизм теплового воздействия все же накладывает ограничение на габариты дезинфицируемых изделий. Данный способ подходит только для инструментов, у которых размерные параметры укладываются в 50 мм.
Особенности холодных методов стерилизации
Группа способов обработки такого типа отличается отсутствием фактора воздействия в виде горячей среды. Это могут быть некоторые из химических методов, физические средства, ультразвуковые, радиационные и другие технологии стерилизации. Методы и режимы очистки с холодными активными средами выгодны тем, что могут использоваться применительно к чувствительным изделиям независимо от материала изготовления. Обработке подвергаются и мягкие пластики, и ткани с деликатными тонкими волокнами. Но обратной стороной холодной стерилизации нередко является риск вредного токсического воздействия, что ограничивает сферы применения таких способов уже по другим параметрам, нежели температурный.
Газовый метод стерилизации

Активными компонентами воздействия выступают комбинации окисей бромистого метила и этилена, а также формальдегидные пары и озон. Для качественной дезинфекции такими средствами тоже требуется определенная регуляция температурного фона, но в минимальных значениях. В частности, режимы стерилизации с окисью этилена предусматривают установку параметра от 18 до 55 °С. Для использования паров формальдегида в спиртовой смеси потребуется температура до 80 °С, и это будет наиболее жесткий термический режим для газовой стерилизации. Но также имеет значение и уровень давления воздушной среды в месте проведения очистки. Для того же этилена обязательным условием будет удаление воздуха до момента достижения уровня давления в 0,9 кгс/см2. Также газовые методы – наиболее продолжительные по времени. Срок обработки может варьироваться от нескольких часов до 7-10 суток. Опять же, длительность удержания изделия под интенсивным воздействием активной среды компенсирует ее щадящие температурные показатели. Чувствительные объекты могут выдержать долгий цикл контакта с газовыми смесями, но даже кратковременное интенсивное влияние агрессивных реагентов может оказаться для них губительным.
Режимы инфракрасной стерилизации
Современный способ очистки, широко используемый для обработки металлического инструмента в разных сферах медицины. Инфракрасное воздействие в зависимости от настроек позволяет уничтожать практически все известные науке микроорганизмы. Причем время обработки можно назвать рекордным – от 1 до 10 мин. На максимальные параметры излучение выходит уже через 30 сек. Различаются режимы стерилизации инструментов посредством ИК-воздействия величиной температуры. Предельный уровень достигает 200 °С, но в зависимости от характеристик материала и размеров предмета могут применяться среды на 50-100 °С. Однако и временной интервал, как и в случае с паровой обработкой, по мере понижения температуры будет увеличиваться.
Контроль процессов стерилизации
В целях выявления некорректной работы аппаратуры и технологических нарушений иного рода на многих предприятиях обслуживание инструмента периодически сопровождается проверкой основных параметров очистки. В их числе обязательными являются температура, давление, коэффициент влажности и время цикла стерилизации. Непосредственно контроль режима стерилизации выполняется высокоточными метрологическими приборами. Это может быть и группа узкоспециализированных устройств наподобие термометров, гигрометров, барометров и т.д, или же многофункциональные станции, охватывающие весь комплекс необходимых для измерения инструментов. Но практикуется и другой подход к контролю стерилизации – посредством оценки биологически и физических признаков.
Индикаторы эффективности стерилизации
Под признаками понимается набор индикаторов, позволяющих составить наглядное представление о тех же параметрах обработки. Существует несколько классов таких маркеров, которые дают информацию о характеристиках процедуры с разных точек зрения. Например, 1 класс индикаторов предназначен для оценки внешних и внутренних процессов. Они характеризуют изменение цвета целевого объекта, когда тот подвергается обработке в том или ином режиме стерилизации с конкретными параметрами температуры и давления. Индикаторы 2 класса вовсе не предназначены для оценки характеристик процесса, а отдельно рассматривают поведение определенных материалов в условиях конкретной среды. Также существуют узконаправленные и многофакторные маркеры, которые, соответственно, дают сведения о конкретных параметрах обработки или же представляют эффект воздействия с учетом совокупности показателей температуры, влажности, давления и времени цикла. Причем особое место в рамках комплексных исследований широкого массива индикаторов занимает не столько характер их влияние на объект, сколько на взаимодействие между собой. Например, каким образом повышение давления может отражаться на эффективности термического компонента очистки.
Заключение
Процедура стерилизации является обязательной в медицинских учреждениях. Конечно, эффективность способа выполнения подобных операций – ключевой фактор выбора подходящего варианта обработки. Но также имеют значение вопросы энергоэффективности и финансовой доступности стерилизации. Методы и режимы, как правило, требуют поддержания довольно высоких температур, что не обходится без специальной аппаратуры. Разовая месячная обработка нескольких инструментов, конечно, не станет заметной статьей затрат. Но для крупного предприятия поточная стерилизация сотен предметов в еженедельном, а иногда и каждодневном формате является весьма существенной финансовой и организационной обузой. Поэтому все чаще наблюдается отход от устоявшихся традиционных методов обработки изделий к более технологичным и современным способам ультразвуковой, инфракрасной и радиационной дезинфекции.
Химические методы стерилизации
К химическим методам относят газовую стерилизацию и стерилизацию растворами антисептиков.
Газовая стерилизация.
Газовая стерилизация осуществляется в специальных герметичных камерах. Стерилизующими агентами обычно являются пары формалина (на дно камеры кладут таблетки формальдегида) или окись этилена. Стерильность инструментария достигается за счет алкилирования протеинов бактерий через 6-48 часов (в зависимости от компонентов газовой смеси и температуры в камере).Рабочей концентрацией окиси этилена является 555мг/л. В связи с тем, что окись этилена взрывоопасна, ее чаще всего используют в смеси с инертными газами (10% окиси этилена и 90% углекислоты). Эта смесь в литературе обозначается как карбокс или карбоксид. Активность окиси этилена возрастает при повышении температуры (в 2,74 раза на каждые 100 С повышения температуры).
Отличительной особенностью метода является минимальное отрицательное влияние на качество инструментария, в связи с чем его используют для стерилизации оптических, особо точных и дорогостоящих инструментов. Метод применятся непосредственно в стационарах.
Стерилизация растворами антисептиков
В основном используется для стерилизации режущих хирургических инструментов.
Для стерилизации используются: тройной раствор А, 96% этиловый спирт и 6% р-р перекиси водорода, спиртовой р-р хлоргексидина, первомур.
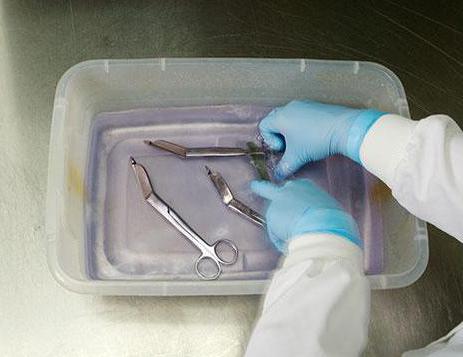
Для «холодной» стерилизации инструменты погружают в разобранном или в раскрытом виде в один из этих растворов. При замачивании в спирте и тройном растворе А инструменты становятся стерильными через 2-3 часа, в перекиси водорода – через 6 часов.
Стерилизация хирургических инструментов
Предстерилизационная подготовка хирургических инструментов, бывших в употреблении, осуществляется следующим образом:
Бывшие в употреблении, но не инфицированные инструменты моют проточной водой щетками в течение 5 минут, затем замачивают в растворе А (пергидроль — 20,0, ПАВ «Астра» — 5,0; вода — 975 мл.) при 50 0С – на 15-20 минут.
Инструменты, загрязненные гноем или кишечным содержимым, помещают в 5% раствор лизола на 30 минут.
Инструменты и шприцы после операции у больного с анаэробной инфекцией замачивают в 6 % растворе перекиси водорода + 0,5 % раствор ПАВ «Астра» на 1 час, затем кипятят 90 минут.
В настоящее время с целью профилактики ВИЧ-инфекции все инструменты после использования перед прохождением обычной предстерилизационной подготовки должны быть замочены в 3% р-ре хлорамина в течение 60 минут или в 6% р-ре перекиси водорода в течение 90 минут.
Стерилизация нережущих металлических инструментов осуществляется с помощью:
Стерилизации в сухожаровом шкафу при t — 180-200 0 C в течение 60 минут.
Автоклавирования при давлении в 2 Атм (132,9 град. С.) в течение 20 минут.
Кипячения в дистиллированной воде с добавлением натрия гидрокарбоната (20 гр. на 1 литр воды) – 45 минут.
Инструменты после операций по поводу анаэробной инфекции и в группе риска по гепатиту или ВИЧ-инфекции кипятить нельзя.
Режущие и колющие инструменты кипятят в течение 3-х минут без добавления гидрокарбоната натрия, затем погружают в 96 % этанол на 2 — 3 часа.
Кипячение шприцов осуществляется в разобранном виде в бидистиллированной воде в течение 45 минут. Стеклянная часть шприца при этом обертывается марлей.
Согласно приказу МЗ N 720 от 31.07.78 инструментарий, используемый во время операции, рекомендуется стерилизовать в сухожаровых шкафах при температуре 180 0С в течение 1 часа. В таких же условиях должны стерилизоваться и режущие инструменты, что приводит к некоторому снижению их остроты, но обеспечивает абсолютную стерильность.
Эти изменения в организации стерилизации связаны с частой высевания патогенной флоры после вышеописанных традиционных способов стерилизации.
Одноразовые инструменты (пинцеты, зажимы, зонды, скальпели) стерилизуются с помощью ионизирующего излучения в заводских условиях.

ТОП 10: |
Семинар 3. Термические методы стерилизации МЕТОДЫ СТЕРИЛИЗАЦИИ Стерилизация является одним из важнейших и необходимых приемов в микробиологической практике. Слово «стерилизация» в переводе с латинского означает «обеспложивание». В практической работе под стерилизацией понимают методы, применяемые для уничтожения всех форм жизни как на поверхности, так и внутри стерилизуемых объектов. Микробиологи стерилизуют питательные среды, посуду, различные инструменты и другие необходимые предметы с целью не допустить развитие посторонних микроорганизмов в исследуемых культурах. Термин «стерильность» имеет абсолютное значение. Можно говорить только либо о стерильности, либо о нестерильности, но не может быть состояния «частичной или неполной стерильности», «близкого к стерильному», «почти стерильного». Различают термическую и холодную стерилизацию. В микробиологии находят применение следующие способы термической стерилизации: прокаливание в пламени и обжигание, сухожаровая стерилизация (горячим воздухом), стерилизация насыщенным паром под давлением (автоклавирование), дробная стерилизация (тиндализация), кипячение. Из методов холодной стерилизации микробиологи используют стерилизацию фильтрованием, газообразными средствами, ультрафиолетовыми лучами и другими видами излучений. Возможность и целесообразность применения того или иного способа определяются в первую очередь физико-химическими свойствами материала, подлежащего стерилизации, а иногда и целью исследования. Процесс автоклавирования. Отдельные операции процесса стерилизации в автоклавах разных типов могут быть несколько различными. Соответственно несколько различается и техника работы с ними, однако общий принцип проведения стерилизации в разных автоклавах одинаковый. Перед работой осматривают автоклав и контрольно-измерительную аппаратуру. При наличии любой неисправности (смещение стрелки манометра с нуля, трещина на водомерной трубке и др.) работать с прибором нельзя. После осмотра автоклава в водопаровую камеру наливают воду до верхней отметки на водомерной трубке. В стерилизационную камеру на специальную подставку из дерева помещают стерилизуемый материал. Предметы следует размещать не слишком плотно, так как пар должен свободно проходить между ними, иначе они не нагреются до нужной температуры и могут остаться нестерильными. Загрузив стерилизационную камеру, устанавливают и плотно завинчивают крышку (дверь) автоклава. Затем открывают кран, соединяющий стерилизационную камеру с наружным воздухом, и включают нагрев. После начала парообразования удаляют воздух из стерилизационной камеры. Это необходимое условие стерилизации, так как при одном и том же давлении температура чистого пара выше температуры смеси пара и воздуха. Если в автоклаве останется воздух, материал может не простерилизоваться. Наиболее простой и очень распространенный способ освобождения автоклава от воздуха — вытеснение воздуха паром. Пар и конденсат отводят либо в сосуд с водой, либо в специальное устройство, соединенное с канализацией. В первом случае на кран (2) надевают резиновый шланг, который опускают в воду. Началом продувания считается появление устойчивой непрерывной струи чистого пара. Пока в автоклаве еще имеется воздух, смесь воздуха и пара, проходя через воду, издает сильный треск. Чистый пар выходит с равномерным шипящим звуком. Его пропускают в течение 10 мин. В целом вся операция с момента появления пара с воздухом должна занимать не более 15 — 20 мин, иначе в автоклаве останется мало воды и он может испортиться. Чтобы уменьшить расход пара (воды), кран открывают не полностью. Степень открывания крана устанавливают на практике при эксплуатации автоклава. В наиболее совершенных автоклавах воздух из стерилизационной камеры удаляют с помощью вакуумного насоса. Когда воздух вытеснен, закрывают пароотводной кран, и давление пара доводят до показания, соответствующего режиму стерилизации. Режим автоклавирования часто выражают в единицах избыточного давления, указывая при этом длительность его поддержания, например стерилизация при 1 ати в течение 20 мин. На манометре автоклава обозначается именно то избыточное давление, которое создается в автоклаве сверх нормального. Нередко режим автоклавирования характеризуется температурой и временем. Как только стрелка манометра дойдет до указателя определенного дополнительного давления и, следовательно, температура пара достигнет соответствующего значения, этот уровень давления пара поддерживают в течение необходимого времени путем ручного или автоматического регулирования подачи пара. В автоматических автоклавах подачу пара регулируют электроконтактным манометром. По окончании времени стерилизации выключают нагрев автоклава. Давление в автоклаве постепенно падает и сравнивается с атмосферным. Лишь после этого открывают кран, выводящий пар. Преждевременное открывание крана недопустимо, так как перегретые среды при резком снижении давления сразу же бурно закипают, смачивают и даже иногда выталкивают ватные пробки, что нарушает стерильность материала. Когда пар выйдет, открывают крышку (дверь) автоклава, соблюдая при этом осторожность во избежание ожога паром лица и рук. Удаление пара из стерилизационной камеры автоклавов, оснащенных вакуумным насосом, осуществляют с помощью насоса. Одновременно происходит подсушивание стерильного материала. Поскольку автоклав работает при высоких давлениях и температурах, неправильное обращение с ним может быть причиной несчастных случаев. Установка автоклава и работа с ним производятся при точном и строгом выполнении правил, указанных в прилагаемой к автоклаву инструкции. К работе допускаются только подготовленные лица, имеющие специальное разрешение. При необходимости проконтролировать температуру в автоклаве пользуются разными веществами, плавящимися при определенной температуре. Эти вещества предварительно смешивают с нейтральными красителями и помещают в автоклав до начала стерилизации. В качестве индикаторов температуры используют фенантрен (температура плавления 98—100°С), бензаурин (115°С), серу (119 °С), бензойную кислоту (121 — 122 °С), мочевину (132°С), глюкозу (146°С), тиомочевину (180°С), аскорбиновую кислоту (187— 192 °С). На 100 г этих веществ берут 0,01 г красителя (фуксин, метиленовый синий), тщательно смешивают, рассыпают в стеклянные трубочки с одинаковым диаметром и толщиной стенок, запаивают и в вертикальном положении раскладывают между стерилизуемым материалом в автоклаве. По достижении в сосуде соответствующей температуры эти вещества расплавляются и окрашиваются в цвет добавленного в них красителя.
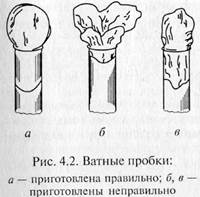
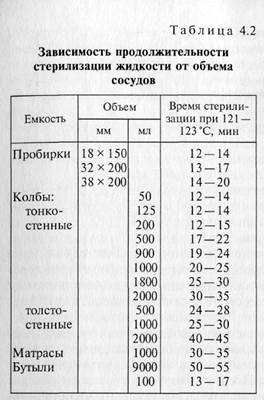
Подготовка сред к стерилизации. При автоклавировании 3 — 5 % жидкости теряется в результате испарения, поэтому рекомендуется в приготавливаемые среды добавлять сверх объема примерно 5 % дистиллированной воды. Тогда после стерилизации среда (раствор) будет иметь требуемую концентрацию. Среды обычно стерилизуют в пробирках, колбах, бутылях. Емкости заполняют средой не более чем на половину их высоты, чтобы предотвратить смачивание пробок. Сосуды со средами закрывают ватными пробками. Они предохраняют среду от заражения микроорганизмами, находящимися в окружающем воздухе. Пробки должны быть достаточно плотными, чтобы выполнять эту функцию, но с достаточно равномерным распределением волокон ваты, так как через них происходит газообмен культур с окружающей средой. Слишком плотные пробки затрудняют снабжение культур воздухом. Для приготовления пробки плоский кусок ваты, взятый вдоль волокна, скатывают валиком. Чтобы придать пробке прочность, ее прокатывают между ладонью и чистым стеклом, лежащим на столе. Длина пробки для обычной пробирки примерно 4 см. Пробка должна входить в пробирку на 1,5 — 2,0 см (рис. 4.2). Для сохранения формы пробку вынимают из горлышка, слегка вращая. Удобно обернуть пробку чистой марлевой салфеткой. Перед стерилизацией пробки можно прикрыть бумажными колпачками. Нельзя обертывать пробки сосудов, которые будут стерилизоваться в автоклаве, целлофаном, фольгой или другими материалами, не пропускающими пар, так как пар должен проникать через пробку в сосуд, иначе среды не нагреются до нужной температуры и не простерилизуются. При использовании стеклянных, резиновых, корковых и других пробок их завертывают в двойной слой оберточной бумаги и стерилизуют привязанными к склянке, закрытой ватной пробкой. Пробки в сосуде меняют стерильно около пламени горелки. Подготовка посуды к стерилизации. Посуда перед стерилизацией должна быть тщательно вымыта и завернута в бумагу для сохранения стерильности после прогревания. Посуду развертывают непосредственно перед употреблением. В верхние концы пипеток вставляют ватные тампоны. Торчащие из пипеток волокна ваты сжигают в пламени горелки. Пипетки заворачивают в длинные полоски бумаги шириной 4 — 5 см. Обмотку начинают с оттянутого конца и постепенным движением бумаги по спирали заканчивают у конца с ватным тампоном. Завернутые пипетки для предохранения бумаги от загрязнения и разрывов перед стерилизацией упаковывают по несколько штук вместе или помещают в специальные металлические или картонные пеналы. Чашки Петри обычно заворачивают в пакеты по 2 —4 штуки, шпатели — по отдельности, но затем, как и пипетки, их объединяют в общий сверток. Колбы, пробирки и трубки Бурри закрывают ватными пробками. На пробки можно надеть бумажные колпачки, предохраняющие горлышко от пыли. Стерилизация. Посуду, подготовленную для стерилизации, загружают в стерилизатор (или сушильный шкаф) не слишком плотно, чтобы обеспечить циркуляцию воздуха и равномерный надежный прогрев стерилизуемого материала. Стерилизатор (сушильный шкаф) во время работы должен быть плотно закрыт. При отсутствии терморегулятора необходимо строго следить за температурой, так как при ее понижении не осуществится стерилизация, а при нагреве выше 180 °С бумага и пробки начинают обугливаться. По окончании стерилизации шкаф не открывают до тех пор, пока температура в нем не упадет до 80 °С, поскольку при резком охлаждении иногда нарушается стерильность материала, а сильно нагретое стекло может растрескаться. Лучше всего выгружать посуду, когда температура в стерилизаторе сравняется с комнатной. Посуду можно стерилизовать и в автоклаве. Режим стерилизации в этом случае существенно зависит от объема сосудов и толщины стекла (см. табл. 4.2). Для автоклавирования посуду готовят, как и для сухожаровой стерилизации. Следует иметь в виду, что в автоклаве посуда увлажняется. Стерилизация фильтрованием.
Фильтрованием стерилизуют синтетические среды строго определенного состава, которые содержат легкоразрушающиеся или летучие компоненты — витамины, аминокислоты (цистеин и цистин), белки, ароматические углеводороды, антибиотики и др. Фильтрование жидкостей осуществляют через мелко -пористые материалы, легко адсорбирующие клетки микроорганизмов: асбест, целлюлозу, фарфор, каолин и т.д. Стерилизующими фильтрами теоретически считают такие, размер пор которых не превышает 0,7 мкм. В практике же пригодность фильтров для стерилизации устанавливают путем пробной фильтрации через них суспензии какого-нибудь мелкого микроорганизма, например Serratia marcescens. Для проверки на стерильность фильтрат в большом количестве высевают на питательную среду. Если в течение 5 сут тест-организм не вырастет, фильтры могут быть использованы для стерилизации. Широкое распространение получили мембранные фильтры. Это диски разного размера, диаметра, напоминающие бумажные. Их готовят на основе нитроцеллюлозы. Мембранные фильтры в зависимости от величины пор применяют для фильтрования и стерилизации. Для стерилизации используют фильтры с номера 1 до номера 4 фирмы «Владипор» (Россия), фильтры с номера 5 до номера 10 фирмы «СИНПОР» (Чехия) и марок VF, VM, VC, SLGS, SLHA, DA фирмы «МИЛЛИПОР» (США). Плотные диски, изготовленные из смеси асбеста с целлюлозой, называются фильтрами Зейтца. В зависимости от диаметра пор они обозначаются разными индексами: ЕК — поры диаметром 1,5 — 1,8 мкм; ЕКS — 1,2—1,5; ЕКS-1 — 1,0— 1,2; ЕКР — 0,8— 1,0 мкм. В России выпускают асбестовые фильтры марок Ф2 и СФ. Стерилизующими являются СФ-3 и СФ-4. Асбестовую пластинку помещают в специальный держатель, который обычно изготавливают из нержавеющей стали, и крепко зажимают винтами между верхней (цилиндрической) и нижней (воронкообразной) частями держателя. Трубка нижней части держателя через резиновую пробку проходит в колбу Бунзена. Нередко весь этот прибор в собранном виде называют фильтром Зейтца.
Для стерилизации используют стеклянные пористые фильтры, а также изготовленные из каолина с примесью кварцевого песка — «свечи» Шамберлана и из инфузорной земли — «свечи» Беркефельда. Пористость первых обозначается буквой L с цифрами от 1 до 13 соответственно уменьшению диаметра пор фильтра от 9 до 1,2 мкм. Мелкопористые «свечи» обозначаются маркой В, крупнопористые — F. Фильтры Беркефельда обозначают буквами V, N, W, что соответствует следующим размерам пор (мкм): 8—12, 5 — 7, 3 — 4.
Мембранные фильтры стерилизуют автоклавированием при 1 ати 15 мин или длительным кипячением. Держатель вместе с резиновой пробкой заворачивают в бумагу и автоклавируют при 1 ати 20 — 30 мин. Фильтры Зейтца автоклавируют в собранном виде. «Свечи» стерилизуют вместе с резиновыми пробками в автоклаве. Колбу Бунзена закрывают ватной пробкой, в отводную трубку вставляют тампон и стерилизуют горячим воздухом — сухим жаром. СТЕРИЛИЗАЦИЯ ИНСТРУМЕНТОВ И ПРИБОРОВ Мелкие металлические инструменты: петли, иглы, пинцеты, ножницы, шпатели — стерилизуют прокаливанием в пламени (т.е. нагреванием докрасна) непосредственно перед использованием. На пламени кратковременно обжигают предметные и покровные стекла, стеклянные шпатели и палочки, фарфоровые ступки и пестики, горлышки колб, пробирок, бутылок, а также ватные пробки при пересевах культур и разливах сред. В пламени погибают и вегетативные клетки, и споры микроорганизмов. Наряду со стерильными одноразовыми шприцами в лабораторной практике широко распространены традиционные шприцы многократного использования. Их лучше всего стерилизовать сухим жаром при 160 °С в собранном либо в разобранном виде. В первом случае длительность стерилизации 75 мин, во втором —60 мин. Собранные шприцы вместе с иглой стерилизуют в пробирке, закрытой ватной пробкой, разобранные заворачивают в бумагу или ткань. Можно стерилизовать шприцы и в автоклаве при 1 ати в течение 15 — 20 мин. Автоклавируют их только в разобранном виде, иначе они повреждаются. Прокаливать шприцы нельзя, так как от этого они портятся. Термостойкие приборы для культивирования микроорганизмов, а также детали к этим приборам, резиновые пробки и шланги стерилизуют в автоклаве. При этом емкости завертывают в бумагу. Режим автоклавирования выбирают в соответствии с термостойкостью материала, из которого сделан прибор. Некоторые предметы (металлические инструменты, мелкие стеклянные детали, мембранные фильтры) иногда стерилизуют длительным (в течение 20 — 30 мин) кипячением в дистиллированной воде. Металлические и стеклянные предметы лучше всего кипятить в специальных закрытых сосудах — стерилизаторах. Можно использовать для этой цели и металлическую посуду. Мембранные фильтры обычно кипятят в колбе или химическом стакане, закрытых ватными пробками. Однако этим способом стерилизации в микробиологической практике пользуются редко в связи с тем, что длительное кипячение может повредить обрабатываемый материал, а сокращение времени кипячения может не обеспечить стерильность, так как споры некоторых микроорганизмов способны сохранять жизнеспособность даже после длительного кипячения. Надежность стерилизации при кипячении может быть увеличена внесением в воду какого-либо бактерицидного средства: 2%-го формальдегида, 1%-й бриллиантовой зелени или 0,1%-й сулемы. Но в этом случае возможно загрязнение биоцидами стерилизуемых предметов. Стерилизация облучением. Для стерилизации помещений, оборудования, некоторых медицинских принадлежностей, пищевых продуктов используют разные виды излучений: инфракрасное, ультрафиолетовое, рентгеновские лучи, альфа-, бета-, гамма-лучи радиоактивных элементов. Единицей дозы облучения является радиан (1 рад = 0,01 Гр), который эквивалентен поглощенной энергии примерно в 100 эрг/г. Стерилизующими являются дозы облучения 2 — 3 Мрад (104Гр, или рад). Чаще других в микробиологической практике используют ультрафиолетовое облучение. Основные способы стерилизации питательных сред, посуды и других лабораторных материалов обобщены в табл. 4.4. Следует отметить, что все большее распространение получают посуда и инструменты одноразового использования.
Семинар 3. Термические методы стерилизации МЕТОДЫ СТЕРИЛИЗАЦИИ Стерилизация является одним из важнейших и необходимых приемов в микробиологической практике. Слово «стерилизация» в переводе с латинского означает «обеспложивание». В практической работе под стерилизацией понимают методы, применяемые для уничтожения всех форм жизни как на поверхности, так и внутри стерилизуемых объектов. Микробиологи стерилизуют питательные среды, посуду, различные инструменты и другие необходимые предметы с целью не допустить развитие посторонних микроорганизмов в исследуемых культурах. Термин «стерильность» имеет абсолютное значение. Можно говорить только либо о стерильности, либо о нестерильности, но не может быть состояния «частичной или неполной стерильности», «близкого к стерильному», «почти стерильного». Различают термическую и холодную стерилизацию. В микробиологии находят применение следующие способы термической стерилизации: прокаливание в пламени и обжигание, сухожаровая стерилизация (горячим воздухом), стерилизация насыщенным паром под давлением (автоклавирование), дробная стерилизация (тиндализация), кипячение. Из методов холодной стерилизации микробиологи используют стерилизацию фильтрованием, газообразными средствами, ультрафиолетовыми лучами и другими видами излучений. Возможность и целесообразность применения того или иного способа определяются в первую очередь физико-химическими свойствами материала, подлежащего стерилизации, а иногда и целью исследования. |
Физические методы стерилизации
Термические методы
Обжигание. В настоящее время не применяется, но его можно использовать при необходимости стерилизации металлических инструментов в полевых условиях. Обжигают инструменты открытым пламенем. В металлическую емкость укладывают инструменты, наливают небольшое количество этилового спирта и поджигают его.
Кипячение. Стерилизация кипячением в последнее время применяется редко. Это обусловлено тем, что при этом методе невозможно добиться уничтожения спороносных микроорганизмов, из-за невозможности достичь температуры выше 100 градусов. Стерилизация производится в электрических стерилизаторах. На специальную сетку помещают инструменты в раскрытом виде (шприцы в разобранном состоянии) и погружают в стерилизатор заполненный дистиллированной водой с добавлением гидрокарбоната натрия (20 г натрия гидрокарбоната на 1 л воды — 2 % раствор). Время стерилизации — 30 минут с момента закипания.
В настоящее время термическая стерилизация производится либо водяным паром в автоклаве при температуре 120-132˚С, либо сухим жаром в сухожаровых стерилизаторах (шкаф) при температуре 170-200˚С. При термической стерилизации необходимо выделять следующие рабочие фазы:
Фаза нагревания – от начала подогрева до достижения предписанной температуры по термометру в рабочей камере;
Время уравновешивания – от момента достижения температуры стерилизации в рабочей камере до момента выравнивания ее в стерилизуемом материале;
Время уничтожения микробов, продолжительность которого предписана инструкцией;
Время охлаждения – от момента прекращения нагревания до снижения температуры до 80˚С при стерилизации сухим жаром и до 60˚С при стерилизации в автоклаве.
Истинное время стерилизации в полезном пространстве состоит из времени уравновешивания, времени уничтожения и времени дополнительной безопасности, обеспечивающего надежность стерилизации (50 % времени).
Стерилизация сухим жаром. Стерилизацию осуществляют в сухожаровых шкафах-стерилизаторах, действующим фактором является воздух, нагретый до 170-200˚С. При сухожаровой стерилизации происходит разогревание стерилизуемых объектов. Так как горячий воздух в отличие от водяного пара служит только переносчиком тепла, температура стерилизуемых предметов должна достигнуть 170-200˚С. Нагревание обеспечивается за счет поступления горячего воздуха через специальный клапан в нижней части воздушного стерилизатора, а его выход – через верхний клапан.
Путем сухожаровой стерилизации можно обрабатывать все термостабильные, негорючие материалы из стекла, металла или фарфора. Сухожаровая стерилизация непригодна для перевязочного материала, резины, катетеров, изделий из бумаги и пластиков.
Стерилизация осуществляется следующим образом:
укладывают инструменты на полки шкафа-стерилизатора
при открытой дверце при температуре 80°С высушивают инструменты в течение 30 минут.
закрыв дверцу шкафа, стерилизуют в течение 1 часа при температуре 180°С.
после остывания стерилизатора до 50-70°С дверцу приоткрывают, а при окончательном остывании инструментарий забирают.
Добавление новых материалов и предметов для стерилизации недопустимо.
Стерилизация паром. Действующим фактором при этом методе является горячий пар. Существует два метода стерилизации: стерилизация текучим паром и стерилизация под давлением. От первого метода в настоящее время отказались, так достигается температура 100˚С, а этого недостаточно для уничтожения некоторых видов микроорганизмов. При стерилизации под давлением вода нагревается при повышенном давлении, поэтому повышается точка кипения воды и соответственно температура пара (при давлении 2 атмосферы до 132,9°С).
Горячий водяной пар служит переносчиком тепла. Он действует интенсивнее, чем горячий воздух, т. к. высокая теплоемкость пара при конденсации переносится на стерилизуемый объект. Одновременно пар действует как непосредственный стерилизатор – стерилизующий агент действует путем гидратирования, коагуляции и гидролиза белков.
Стерилизация паром осуществляется в автоклавах. Аппарат для стерилизации под давлением (автоклав) состоит из двух металлических цилиндров разного диаметра, вставленных один в другой так, что между ними остается пространство, которое наполняется водой. Во внутреннюю камеру автоклава кладут стерилизационные коробки с фильтром, биксы с перевязочным материалом или пакеты с инструментами в двухслойной упаковке из бязи или в пергаментной бумаге. Плотно завинчивают боковую дверь парового стерилизатора и начитают стерилизацию в заданном режиме. Паровой стерилизатор оборудован термометром, манометром (указывает давление пара внутри аппарата) и предохранительным клапаном, который срабатывает при нарастании избыточного давления.
Все предметы, которые не выдерживают высокой температуры жаровой стерилизации и для которых температура пара не является повреждающей, должны стерилизоваться автоклавированием (перевязочный материал, резиновые и синтетические предметы, бумажные фильтры, закрытые ампулы и банки с водосодержащими препаратами и др.).
Перевязочный материал, белье, инструменты укладываются в металлические коробки (бикс Шиммельбуша), закрывают крышку и, оставив открытыми боковые отверстия, биксы загружают в автоклав. Проводить стерилизацию можно в 3 режимах — при давлении 1,1 атмосферы — 1 час, 1,5 атмосферы — 45 минут, 2 атмосферы — 30 минут. Перчатки стерилизуются при 1,1 атм. в течение 45 минут или при 1,5 атм. — 15-20 минут. Хирургические инструменты и шприцы при 2 атм’ 20 мин
По истечении времени стерилизации биксы оставляют для просушки в автоклаве при приоткрытой крышке последнего. Боковые отверстия закрываются сразу после извлечения бикса из автоклава. На стерильный бикс прикрепляют бирку с указанием даты стерилизации. Закрытый бикс остается стерильным 72 часа. В случае открытия — 24 часа.
Основными методами стерилизации в настоящее время являются — стерилизация сухим жаром и стерилизация паром под давлением. В лечебных учреждениях для проведения стерилизации создаются центральные стерилизационные отделения (ЦСО), где и осуществляется стерилизация инструментов (шприцы, иглы, простые хирургические наборы, зонды, катетеры и пр.) для всех отделений больницы. Хирургический инструментарий, стерилизуется в операционных блоках.
Лучевая стерилизация
Для стерилизации может применяться ионизирующее излучение (Υ-лучи), ультрафиолетовые лучи и ультразвук. Наиболее часто применяется первый вид.
Стерилизацию ионизирующим излучением применяют для стерилизации шприцов, шовного материала, катетеров, зондов систем для переливания и. т. д. Инструменты и материалы стерилизуют в герметичных упаковках в заводских условиях в специальных помещениях. Срок хранения при таком методе стерилизации 5 лет. Преимуществом этого вида стерилизации заключается в том, что при его применении не теряются свойства стерилизуемых объектов.
Стерилизация растворами химических средств
Стерилизующее средство | Режим стерилизации | Вид изделий, рекомендуемых к стерилизации данным методом | Условия проведения стерилизации | ||||
Температура, град. С | Концентрация рабочего раствора, % <1> | Время стерилизационной выдержки, мин | |||||
номинальное значение | предельное отклонение | Номинальное значение, предельное отклонение | |||||
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
Перекись водорода (Россия) <2> | Не менее 18 50 <3> | — +/- 2 | 6,0 6,0 | 360 180 | +/- 5 +/- 5 | Изделия из полимерных материалов (резины, пластмассы), стекла, коррозионностойких металлов Изделия из полимерных материалов (резины на основе силиконового каучука, пластмассы) стекла, коррозион-ностойких металлов Лигатурный шовный материал (нити хирургические шелковые крученые, нити хирургические капроновые крученые, шнуры хирургические полиэфирные) Изделия из полимерных материалов (резины, пластмассы), стекла, металлов, в т.ч. эндоскопы и инструменты к ним | Полное погружение изделий в раствор (с заполнением каналов и полостей) на время стерилизационной выдержки |
Дезоксон-1, Дезоксон-4 (Россия) | Не менее 18 | — | 1,0 | 45 | +5 | ||
Первомур (Россия) | Не менее 18 | — | 4,8 | 15 | +5 | ||
Бианол («НИОПИК», Россия) | 21 | +/- 1 | 20,0 | 600 | +5 | ||
Лизоформин 3000 («Лизоформ Д-р Ханс Роземанн ГмбХ»,Берлин/Германия) | 40 50 <3> | +/- 1 +/- 1 | 8,0 8,0 | 60 60 | +5 +5 | Изделия из полимерных материалов (резины, пластмассы), стекла, металлов, в т.ч. эндоскопы и инструменты к ним | Полное погружение изделий в раствор (с заполнением каналов и полостей) на время стерилизационной выдержки |
КолдСпор («Метрекс Ресерч Корпорэйшн», США) | 21 | +/- 1 | 20,0 | 540 | +5 | То же | |
Глутарал, Глутарал-Н (Россия) | 21 | +/- 1 | Применяют без разведения | 240 | +5 | Инструменты из металлов | |
600 | +5 | Изделия из полимерных материалов (резины, пластмассы), стекла, металлов, в т.ч. эндоскопы и инструменты к ним | |||||
Сайдекс («Джонсон энд Джонсон Медикал Лтд.», Великобритания) | 21 | +/- 1 | Применяют без разведения | 240 | +5 | Инструменты из металлов | |
600 | +5 | Изделия из полимерных материалов (резины, пластмассы), стекла, металлов, в т.ч. эндоскопы и инструменты к ним | |||||
Стераниос 20% концентрированный («Аниос», Франция) | 21 | +/- 1 | 2,0 | 300 | +5 | Эндоскопы, изделия из стекла, пластмасс, инструменты простой конфигурации из металлов | |
360 | +5 | Медицинские инструменты к гибким эндоскопам, изделия из резин, инструменты из металлов, имеющие замковые части, вращающиеся стоматологические инструменты | |||||
Дюльбак растворимый («Петтенс — Франс — Химия», Франция) | 20 | +1 | Применяют без разведения | 240 | +5 | Инструменты из металлов | Полное погружение изделий в раствор (с заполнением каналов и полостей) на время стерилизационной выдержки |
360 | +5 | Изделия из полимерных материалов (резины, пластмассы), в т.ч. гибкие эндоскопы, инструменты к ним | |||||
Гигасепт ФФ («Шюльке и Майр» Германия) | 21 | +/- 1 | 10,0 | 600 | +5 | Изделия из полимерных материалов (резины, пластмассы), стекла, металлов, в т.ч. эндоскопы и инструменты к ним | |
Анолиты (Россия) <4> | Не менее 18 | — | 0,02-0,05 <4> | 15- 300 <4> | +5 | Изделия из полимерных материалов (резины, пластмассы), стекла, сплавов титана (последние — кроме стерилизации «кислыми анолитами») | |
Примечания: <1> Концентрация растворов средств Бианол, Лизоформин 3000, КолдСпор, Гигасепт ФФ приведена по препарату, средства Первомур — по суммарному содержанию 30-33% перекиси водорода и 100% муравьиной кислоты, растворов остальных средств — по действующему веществу.
<2> Допускается использование только медицинской перекиси водорода.<3> Температура раствора в момент погружения в него изделий; в процессе стерилизации указанную температуру не поддерживают.<4> Электрохимически активированные растворы с рН от 2,0 до 8,4 в зависимости от типа анолита («кислый анолит», «нейтральный анолит», «нейтральный анолит АНК»), вырабатываемые в установках ЭХА-30, СТЭЛ-МТ-1, СТЭЛ-МТ-2, СТЭЛ-4Н-60-01, СТЭЛ-4Н-60-02, СТЭЛ-1ОАК-120-01, СТЭЛ-1ОН-120-01. Анолиты используют без разведения. Конкретные режимы стерилизации приведены в методических указаниях по применению растворов, вырабатываемых конкретными установками.
Методы контроля эффективности стерилизации
В комплексе мероприятий по стерилизации изделий медицинского назначения важное значение имеет организация и проведение контроля за ее эффективностью. Используемые до настоящего времени методы и средства контроля не всегда позволяют выявить дефекты стерилизации, что влечет за собой повышение уровня внутрибольничных инфекций.
Контроль эффективности работы стерилизационного оборудования осуществляется:
Надежность этих методов неодинакова. Физические и химические методы предназначены для оперативного контроля и позволяют контролировать соблюдение параметров режимов паровой, газовой, воздушной стерилизации, температуру, давление, экспозицию.
Недостаток этих методов заключается в том, что они не могут служить доказательством эффективной стерилизации. Достоверным для определения эффективности является только бактериологический метод.
Физические методы
Физические методы контроля осуществляются с помощью средств измерения температуры (термометры, термопары), давления (манометры, мановакуумметры) и времени (таймеры). Современные стерилизаторы оснащены также записывающими устройствами, фиксирующими отдельные параметры каждого цикла стерилизации.
Химические методы
В течение десятков лет для проведения химического контроля применялись химические вещества, изменяющие свое агрегатное состояние или цвет при температуре, близкой к температуре стерилизации (бензойная кислота для контроля паровой стерилизации, сахароза, гидрохинон и ряд других веществ — для контроля воздушной стерилизации).
При изменении цвета и расплавлении указанных веществ результат стерилизации признавался удовлетворительным. Однако многолетние наблюдения и данные литературы указывают, что при удовлетворительных результатах химического контроля с помощью названных индикаторов, бактериологический контроль в ряде случаев (до 12%) выявляет неудовлетворительный результат стерилизации.
Кроме того, эти вещества имеют существенный недостаток. Переход их в другое агрегатное состояние не дает представления о продолжительности воздействия температуры, при которой происходит их расплавление.
Принимая во внимание недостаточную достоверность использования указанных индикаторов для контроля, а также значительную трудоемкость и неудобство их практического применения, в 70-х годах были разработаны химические индикаторы, изменение цвета которых происходит при воздействии температуры, принятой для данного режима, в течение времени, необходимого для стерилизации.
По изменению окраски этих индикаторов можно судить о том, что основные параметры процесса стерилизации — температура и время — выдержаны.
Длительное применение таких индикаторов показало их высокую надежность.
Более сложные индикаторы предназначены для контроля критических параметров процесса стерилизации
Критическими параметрами являются:
для парового метода стерилизации — температура, время воздействия данной температуры, водяной насыщенный пар;
для воздушного метода стерилизации — температура и время воздействия данной температуры;
для газовых методов стерилизации — концентрация используемого газа, температура, время воздействия, уровень относительной влажности; для радиационной стерилизации — полная поглощенная доза.
С января 2002 года в России введен в действие ГОСТ Р ИСО 11140-1 «Стерилизация медицинской продукции. Химические индикаторы. Общие требования». Согласно этому документу химические индикаторы распределены на шесть классов.

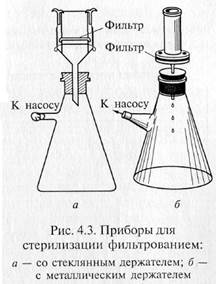
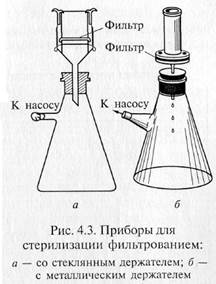

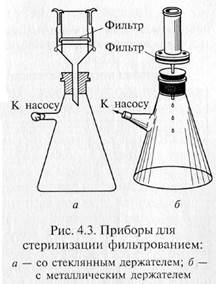
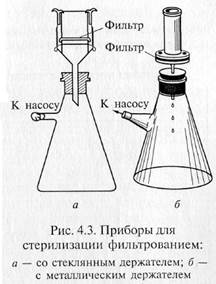
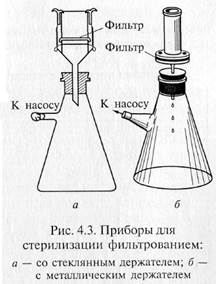
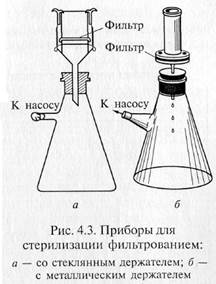 «Свечи» и специальные держатели с закрепленными в них асбестовыми фильтрами герметически соединяют с колбой Бунзена для фильтрации в вакууме (рис. 4.3). Перед употреблением фильтры, их держатели и приемник фильтрата должны быть простерилизованы.
«Свечи» и специальные держатели с закрепленными в них асбестовыми фильтрами герметически соединяют с колбой Бунзена для фильтрации в вакууме (рис. 4.3). Перед употреблением фильтры, их держатели и приемник фильтрата должны быть простерилизованы.